三、肝
肝是人体最大的腺,它产生的胆汁经胆管输入十二指肠,参与脂类物质的消化,故通常将肝列为消化腺。但肝的结构和功能与其他消化腺有很大不同,例如:肝细胞的排列分布特殊,不形成类似胰腺和唾液腺的腺泡;肝内有丰富的血窦,肝动脉血以及由胃肠、胰、脾的静脉汇合而成的门静脉血均输入肝血窦内;肝细胞既产生胆汁排入胆管,又合成多种蛋白质和脂类物质直接分泌入血;由胃肠吸收的物质除脂质外全部经门静脉输入肝内,在肝细胞内进行合成、分解、转化、贮存。因此,肝又是进行物质代谢的重要器官。此外,肝内还有大量巨噬细胞,它能清除从胃肠进入机体的微生物等有害物。
肝表面覆以致密结缔组织被膜,并富含弹性纤维,被膜表面大部有浆膜覆盖。肝门处的结缔组织随门静脉、肝动脉和肝管的分支伸入肝实质,将实质分隔成许多肝小叶。
(一)肝小叶
肝小叶(hepatic lobule)是肝的基本结构单位,呈多角棱柱体,长约2nm,宽约1mm ,成人肝约有50万~100万个肝小叶(图13-9)。小叶之间以少量结缔组织分隔,有的动物(如猪)的肝小叶分界明显,而人的肝小叶间结缔组织很少,相邻肝小叶常连成一片,分界不清(图13-10)。肝小叶中央有一条沿其长轴走行的中央静脉(central vein),中央静脉周围是大致呈放射状排列的肝细胞和肝血窦。
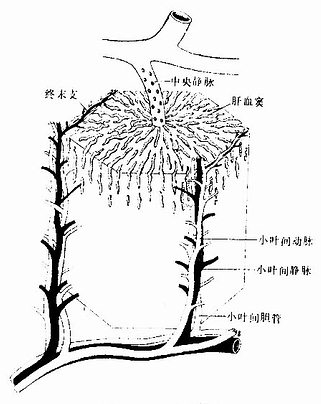
图13-9 肝小叶模式图
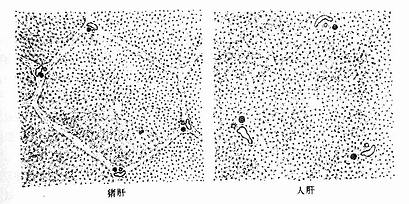
图13-10 肝小叶横切图
正常肝内的结缔组织仅占肝体积的4%左右,主要分布在肝小叶之间,肝小叶则占肝体积96%。肝细胞是构成肝小叶的主要成分,约占肝小叶体积的75%。肝细胞以中央静脉为中心单行排列成板状,称为肝板(hepatic plate)。肝板凹凸不平,大致呈放射状,相邻肝板吻合连接,形成迷路样结构。肝板之羊为肝血窦,血窦经肝板上的孔互相通连,形成网状管道(图13-11)。在切片中,肝板的断面呈索状,称肝索(hepatic cord)(图13-12)。肝细胞相邻面的质膜局部凹陷,形成微细的小管,称胆小管,胆小管在肝板内也相互连接成网(图13-11)。
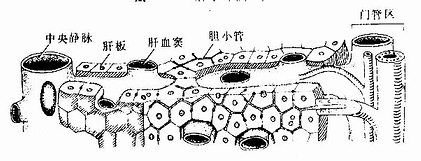
图13-11 肝板、肝血窦与胆小管关系模式图
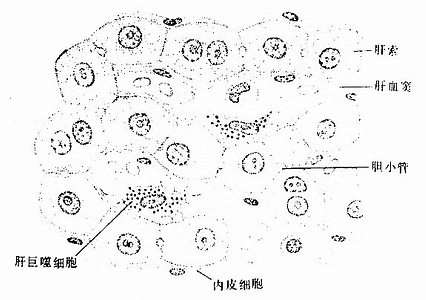
图13-12 肝索与肝血窦
1.肝细胞 肝细胞(hepatocyte)体积较大,直径20~30μm,呈多面体形。肝细胞有三种不同的功能面:血窦面、细胞连接面和胆小管面。血窦面和胆小管面有发达的微绒毛,使细胞表面积增大。相邻肝细胞之间的连接面有紧密连接、桥粒和缝隙连接等结构(图13-13)。
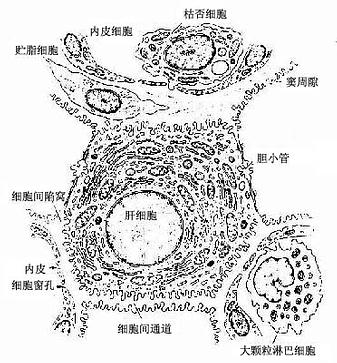
图13-13 肝细胞、肝血窦、窦周隙及胆小管的关系图解

图13-14 大鼠肝细胞电镜像 ×16100
N细胞核,RER粗面内质网,M线粒体,G高尔基复合体,Ly溶酶体,BC胆小管
(上海医科大学电镜室供图)
肝细胞核大而圆,居中央,常染色质丰富丰色浅,核膜清楚,核仁1至数个。部分肝细胞(约25%)有双核,有的肝细胞的核体积较大,为多倍体核。肝细胞核DNA含量分析,正常成体肝细胞以四倍体核占多数,约占肝细胞总数的70%左右,还有少量八倍体肝细胞。一般认为,双核肝细胞和多倍体肝细胞的功能比较活跃。肝细胞是一种高度分化并具有多种功能的细胞,胞质内各种细胞器丰富而发达,并含有糖原,脂滴等内涵物(图13-14)。细胞器和内涵物的含量与分布常因细胞的功能状况或饮食变化而变动。在HE染色切片中,肝细胞质呈嗜酸性,并含有散在的嗜碱性物质,它是由粗面内质网组成的结构。
线粒体:每个肝细胞约有2000个左右,遍布于胞质内,为肝细胞的功能活动不断提供能量。
粗面内质网(RER):成群分布于胞质内,是肝细胞合成多种蛋白质的基地。血浆中的白蛋白、纤维蛋白原、凝血酶原、脂蛋白、补体蛋白以及许多载体蛋白等都是在RER的核糖体上合成。然后经内质网池转移到高尔基复合体,组装形成运输小泡或直接经胞质的基质,从血窦面排出。
滑面内质网(SER):广泛分布于胞质内,SER膜上有多种酶系分布,如氧化还原酶、水解酶、转移酶、合成酶等。肝细胞摄取的各种有机物可在SER进行连续的合成、分解、结合和转化等反应,故肝细胞SER有多种功能,如胆汁合成和胆红素、脂类与激素的代谢以及生物转化等。胆汁中的重要成分胆酸,是在SER的酶作用下由胆固醇转变而成。肝细胞从血液中摄取的脂肪酸,是在SER的酶作用下由胆固醇转变而成。肝细胞从血液中摄取的胆红素,在SER上的葡萄糖酸转移酶的作用下转变为水溶性的结合胆红素,经胆汁排出。肝细胞摄取的脂肪酸,在SER上再度酯化为甘油三脂,并与蛋白质结合形成极低密度脂蛋白(VLDL)。多种激素尤其是类固醇激素的灭活,也是在SER上进行的。机体代谢过程中产生的某些有毒产物或从肠道吸收入肝的有害物质(药物、腐败产物等),经SER的酶氧化、还原、水解、结合等生物转化作用,使其毒性减弱或水溶性增强而易于排泄。若经常服用某些药物(如巴比妥等),可促使肝细胞的SER增生,酶活性增强,机体对这些药物的耐受性也增强。
高尔基复合体:每个肝细胞约有50个。高尔基复合体参与肝细胞的分泌活动,RER合成的蛋白质转移到高尔基复合体进行加工或贮存,然后经运输小泡由血窦面排出。肝细胞近胆小管处的高尔基复合体尤为发达,与胆小管面质膜的更新及胆汁的排泌有关。
溶酶体:数量和大小不一。肝细胞吞饮的物质、退化的细胞或细胞内过剩物质常与溶酶体融合,被水解酶消化分解,或滞留在溶酶体内。溶酶体的这种作用,对肝细胞结构的不断更新和细胞正常功能的维持十分重要。
过氧化物酶体(微体):为圆形小体,大不不一,人肝细胞微体呈均质状结构,有的动物(鼠)肝细胞微体有致密核芯。微体内主要含过氧化氢酶和过氧化物酶,它们可将细胞代谢产生的过氧化氢还原为水,以消除过氧化氢对细胞的毒性作用。微体内还有黄嘌呤氧氧化酶等,它们能将核酸的代谢产物嘌呤氧化为尿酸,由尿中排出。鼠肝细胞微体内的核芯含尿酸氧化酶,人肝细胞微体内无核芯,也不含尿酸氧化酶。
内涵物:肝细胞内有糖原、脂滴、色素等内涵物,它们的含量因机体的生理和病理状况的不同而异。进食后糖原增多,饥饿时糖原减少。正常肝细胞内脂滴少,肝病时脂滴多。肝细胞胞质的色素有胆红素、含铁血黄素、脂褐素等,它们也可以贮存在溶酶体内,脂褐素的含量随机体年龄的增长而增多。
2.肝血窦 肝血窦(hepatic sinusoid)位于肝板之间,互相吻合成网状管道。血窦腔大而不规则,血液从肝小叶的周边经血窦流向中央,汇入中央静脉。血窦壁由内皮细胞组成,窦腔内有定居于肝内的巨噬细胞和大颗粒淋巴细胞。
内皮细胞:内皮细胞是构成肝血窦壁的主要成分,细胞扁而薄,含核的部分凸向窦腔。扁薄的胞质有许多大小不等的窗孔,小者直径0.1μm,大者直径达1~2μm,小窗孔常聚集成群,形成筛样结构,孔上无隔膜(图13-15)。胞质内细胞器较少,但吞饮小泡较多。内皮外无基膜,伏见散在的网状纤维(图13-13)。内皮细胞间常有0.1~0.5μm宽的间隙。因此肝血窦通透性大,血浆中除乳糜微粒外,其他大分子物质均可自由通过,肝细胞产生的脂蛋白等也可通过血窦壁进入血窦,这有利于肝细胞摄取血浆物质和排泌其分泌产物。
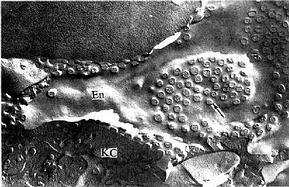
图13-15豚鼠肝冷冻蚀刻复型电镜像 示血窦内皮细胞孔(↑)
En内皮细胞,KC枯否细胞
(河北医学院王仲涛教授供图)
肝巨噬细胞:又称枯否细胞(Kupffer cell),是定居在肝内的巨噬细胞。细胞形态不规则,有许多板状或丝状伪足,细胞表面有许多皱褶和微绒毛,并有较厚的糖衣。细胞常以其伪足附于内皮细胞上或穿过内皮细胞窗孔或细胞间隙伸入窦周隙内(图13-16)。胞质内溶酶体甚多,并常见吞噬体和残余体。肝巨噬细胞来自血液单核细胞,是体内固定型巨噬细胞中最大的细胞群体。肝巨噬细胞具有变形运动和活跃的吞饮与吞噬能力,构成机体一道重要防线,尤其在吞噬清除从胃肠进入门静脉的细菌、病毒和异物方面起关键作用。肝巨噬细胞还可监视、抑制和杀伤体内的肿瘤细胞,尤其是肝癌细胞,并能吞噬和清除衰老、破碎的红细胞和血小板等。此外,肝巨噬细胞还有处理和传递抗原、诱导T细胞增殖及参与调节机体免疫应答等作用。
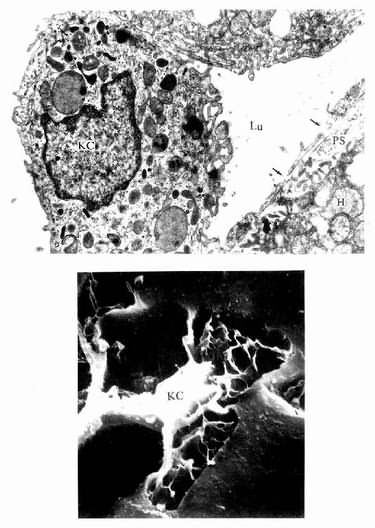
图13-16 肝巨噬细胞(KC)电镜像
上图 大鼠肝 ×24000(上海医科大学电镜室供图)
Lu血窦腔,H肝细胞,PS窦周隙,↑内皮细胞孔
下图足月胎儿冷冻割断扫描电镜像
(河北医学院吴淑兰教授供图)
大颗粒淋巴细胞:肝内的大颗粒淋巴细胞(large granular lymphocyte,,简称LGL),是近10年来被确认的,最初称为pit细胞,并被误认为是一种内分泌细胞,以后的研究证实它是一种对肿瘤细胞等有自然杀伤作用的大颗粒淋巴细胞。LGL一般较牢固地附着在内皮细胞或枯否细胞表面,在门静脉高压灌注时,LGL可游离下来。细胞近圆形,表面有短小突起,细胞核较大,一侧有齿状凹陷,偏居于细胞一侧,核膜下染色质致密。在核凹陷处胞质内有高尔基复合体和中心体,一侧胞质内有少量线粒体及一些圆形或椭圆形的膜包颗粒,直径0.3~0.6μm,颗粒具溶酶体性质(图13-13),LGL具有NK细胞活性和表面标志,它对肿瘤细胞和病毒感染的肝细胞有直接杀伤作用。因此认为,LGL也是构成肝防御屏障的重要组成部分。
3.窦周隙和贮脂细胞血窦内皮细胞与肝细胞之间有宽约0.4μm的狭小间隙,称窦周隙(perisinusoidal space)或Disse隙(图13-13,13-16)。血窦内的血浆成分经内皮细胞窗孔进入窦周隙,故窦周隙内充满血浆,肝细胞血窦面的微绒毛伸入窦周隙,浸于血浆之中。肝小叶的窦周隙也是互相通连网状通道。它是肝细胞与血液之间进行物质交换的场所。扫描电镜观察,有的肝细胞相邻面之间有贯通的细胞间通道,并与窦周隙相通,表面也有许多微绒毛,使肝细胞有更广大的表面与血浆进行物质交换(图13-13)
窦周隙内有散在的网状纤维,起支持血窦内皮的作用;还有一种散在的细胞称贮脂细胞(fat-storing cell)或称Ito细胞,细胞形态不规则,有突起,附于内皮细胞外表面及肝细胞表面。细胞周围常见网状纤维(图13-13)。HE染色切片中不易辨认贮脂细胞,用氯化金浸染或免疫细胞化学可显示。电镜下,贮脂细胞的结构特征是胞质内含有许多大小不一的脂滴,粗面内质网和高尔基复合体也较发达(图13-17)。实验证明,贮脂细胞的脂滴内含有维生素A,当给动物以大量维生素A后,贮脂细胞数及其脂滴显著增多,细胞体积增大,脂滴内贮有维生素A。贮脂细胞还有产生胶原的功能,在肝纤维化病变中,贮脂细胞增多,结构类似于成纤维细胞,并产生大量网状纤维。故认为贮脂细胞是一种特殊的成纤维细胞,它在肝正常微环境中,细胞内形成脂滴,以摄取和贮存维生素A功能为主,而合成胶原功能表达受抑制;在病理状况下,贮脂细胞增多并转化为成纤维细胞,合成胶原的功能增强,与肝纤维增生性病变的发生有关。
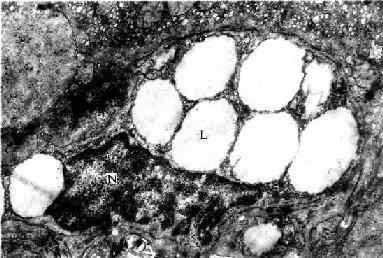
图13-17 人肝贮脂细胞电镜像 ×16000
N贮脂细胞核,L脂滴
(上海医科大学电镜室供图)
4.胆小管 胆小管(bile canaliculi)是相邻两个肝细胞之间局部胞凹陷形成的微细管道,直径0.5~1.0μm,用银染法或ATP酶组化染色法可清楚显示。它们在肝板内连接成网格状管道(图13-18),电镜下观察,胆小管腔面有肝细胞形成的微绒毛突入腔内,胆小管周围的肝细胞膜形成紧密连接、桥粒等连接复合体封闭胆小管(图13-13,13-19,13-20)。正常情况下,肝细胞分泌的胆汁排入胆小管,胆汁不会从胆小管溢出至窦周隙;当肝细胞发生变性、坏死或胆道堵塞内压增大时,胆小管的正常结构被破坏,胆汁则溢入窦周隙,进而进入血窦,出现黄疸。
图13-18 兔肝硝酸银浸染示胆小管 ×320
CV 中央静脉
(二)肝门管区
从肝门进出的门静脉、肝动脉和肝管,在肝内反复分支,伴行于小叶间结缔组织内(图13-9)。在肝切片中,肝小叶周围的角缘处,可见较多的结缔组织,其中含有上述三种伴行管道的断面,称为门管区(portal area)。每个肝小叶的周围一般有3~4个门管区,门管区内主要有小叶间静脉、小叶间动脉和小叶间胆管,此外还有淋巴管和神经纤维(图13-21)。
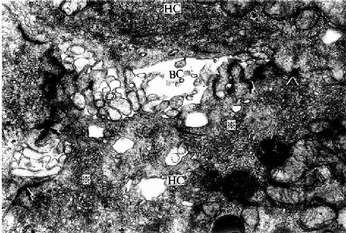
图13-19 大鼠肝电镜像示胆小管 ×30000
BC胆小管,HC肝细胞,↑紧密连接,( )桥粒,
)桥粒,
※高尔基复合体
(上海医科大学电镜室供图)
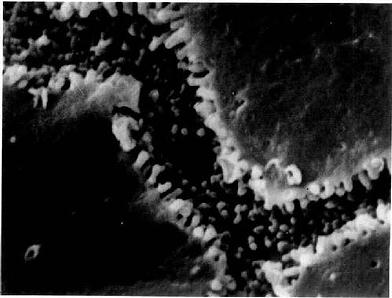
图13-20 大鼠肝冷冻割断扫描电镜像示胆小管
(河北医学院应国华教授供图)
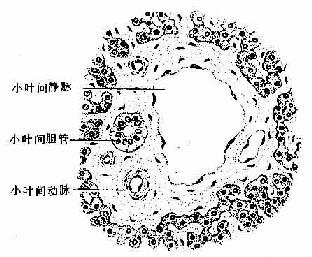
图13-21 肝门管区
小叶间静脉:是门静脉的分支,管腔较大而不规则,壁薄,内皮外仅有少量散在的平滑肌。
小叶间动脉:是肝动脉的分支,管径较细,腔较小,管壁相对较厚,内皮外有几层环行平滑肌。
小叶间胆管:是肝管的分支,管壁由单层立方或低柱状上皮构成。
(三)肝内血液循环
进入肝的血管有门静脉和肝动脉,故肝的血供丰富。门静脉是肝的功能血管,将从胃肠吸收的物质输入肝内。门静脉在肝门处分为左右两支,分别进入肝左、右叶,继而在肝小叶间反复分支,形成小叶间静脉。小叶间静脉分出小支,称终末门微静脉(terminal portal venule),行于相邻两个肝小叶之间。终末门微静脉的分支与血窦相连,将门静脉血输入肝小叶内。肝动脉血富含氧,是肝的营养血管。肝动脉的分支与门静脉的分支伴行,依次分为小叶间动脉和终末肝微动脉(terminal hepatic arteriole),最后也通入血窦。小叶间动脉还分出小支,供应被膜、间质和胆管。因此,肝血窦内含有门静脉和肝动脉的混合血液。肝血窦的血液,从小叶周边流向中央,汇入中央静脉。中央静脉的内皮外无平滑肌,仅有少量结缔组织。若干中央静脉汇合成小叶下静脉,它单独行于小叶间结缔组织内,管径较大,壁较厚。小叶下静脉进而汇合成2~3支肝静,出肝后入下腔静脉。
(四)肝内胆汁排出途径
胆小管内的胆汁从肝小叶的中央流向周边。胆小管于小叶边缘处汇集成若干短小的管道,称闰管或Hering管。闰管较细,上皮由立方细胞组成,细胞着色浅,胞质内的细胞器较少。闰管与小叶间胆管相连,小叶间胆管向肝门方向汇集,最后形成左、右肝管出肝。
(五)肝的淋巴和神经
肝产生大量淋巴,胸导管内的淋巴有25%~50%来自肝。肝淋巴管分布于被膜内和小叶间管道周围。肝小叶内无淋巴管。肝的淋巴主要来自窦周隙的血浆。窦周隙的血浆从小叶中央流向周边,在小叶边缘沿血管周围间隙流至小叶间结缔组织内,继而被吸收入淋巴管,形成淋巴,故肝淋巴富含蛋白质。当肝细胞坏死或胆道阻塞时,胆汁溢入窦周隙,肝淋巴也含胆汁成分。
交感和副交感神经纤维随血管入肝并分支,在门管区的血管周形成神经丛,神经末梢穿入管壁内终止于平滑肌细胞,调节血管的舒缩及肝内血流量。在某些动物还发现部分肾上腺素能神经纤维穿入肝小叶,行于窦周隙内,其终末附于肝细胞和贮脂细胞上,可能参与调节这些细胞的功能活动。此外,肝内也有感觉神经末梢,主要分布在被膜和小叶间结缔组织内,司痛觉。
(六)门管小叶和肝腺泡
以中央静脉为中心的肝小叶称为经典肝小叶(classic lobule),它作为肝的基本结构单位至今仍习惯应用。此外,还有门管小叶和肝腺泡两种肝结构单位的概念(图13-22)。
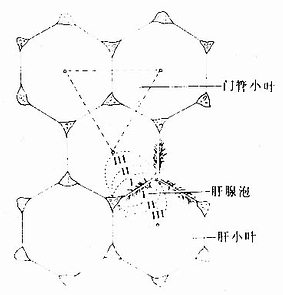
图13-22 肝小叶、门管小叶与肝腺泡的关系图解
1.门管小叶有人认为肝结构单位也应与一般外分泌腺一样以导管为中心,门管小叶(portal lobule)是以门管区内的胆管为中心的三角形柱状体,三个角缘处为相邻肝小叶的中央静脉(图13-22)。门管小叶内的胆汁从周边流向中央,汇入小叶中央的胆管(即前述的小叶间胆管)。故门管小叶的概念是强调肝的外分泌性质。
2.肝腺泡 肝腺泡(hepatic acinus)是肝结构单位的一种较新的概念。肝细胞是行使肝功能的主要成分。肝细胞的代谢活动与肝内血循环关系密切。肝腺泡是应用肝血管灌注法,根据肝细胞与肝内微循环血流的关系而建立的。肝腺泡的体积较小,立体形态似橄榄,平面呈卵圆形。它以门管区血管发出的终末门微静脉和终末肝微动脉及胆管分支为中轴,两端以邻近的两个中央静脉为界(图13-22)。故一个肝腺泡是由相邻两个肝小叶各1/6部分组成的,其体积约为肝小叶的1/3。每个肝腺泡接受一个终末血管(门静脉系和肝动脉系)的血供,因而它是以微循环为基础的肝最小结构单位。
肝腺泡内的血流从中轴单向性地流向两端的中央静脉,根据血流方向及肝细胞获得血供的先后优劣的微环境差异,将肝腺泡分为三个带(图13-22):①近中轴血管的部分为Ⅰ带,肝细胞优先获得富于氧和营养成分的血供,细胞代谢活跃,再生能力强;②Ⅰ带的外侧为Ⅱ带,肝细胞营养条件次于Ⅰ带;③近中央静脉的腺泡两端部分为Ⅲ带,肝细胞营养条件较差,细胞再生能力也较弱,易受药物和有毒物质的损害。不良、酒精中毒、药物中毒或病毒性肝炎时,常首先起Ⅲ带肝细胞变性坏死。肝腺泡概念与肝的病理变化有关,故有一定实际意义。
(七)肝细胞的异质性
近些年通过肝细胞超威结构形态计量和生物化学的深入研究,证明肝小叶内的肝细胞有结构和功能的梯度差异。这种差异主要取决于肝小叶内血流动力以及氧和营养供应的差别,即肝细胞所处的微环境的差异。自肝腺泡的概念被肯定后,肝细胞异质性问题也渐被证实并受到重视。如大鼠肝腺泡Ⅰ带肝细胞的线粒体总体积比Ⅲ带的大,Ⅲ带肝细胞的滑面内质网总面积较Ⅰ带大,Ⅰ带肝细胞的吞饮活动较Ⅲ带的强等。各带肝细胞还表现一定生化功能的异质性,如物质的摄取、合成和代谢以及生物转化和胆汗分泌等方面。肝细胞从血窦摄取物质一般是从肝腺泡Ⅰ带至Ⅲ带递减。Ⅰ带肝细胞以糖原合成和葡萄糖产生为主,Ⅲ带肝细胞则以葡萄糖的利用为主。巴比妥诱导后的细胞色素P[XB]450[/XB]反应主要在Ⅲ带肝细胞,Ⅲ带肝细胞中的葡萄糖醛酸转移酶活性也较Ⅰ带高5倍,而硫化结合反应的酶活性则Ⅰ带肝细胞较明显。Ⅰ带和Ⅱ带肝细胞主要参与胆酸的转运和分泌胆盐依赖性胆汁;Ⅲ带肝细胞则主要分泌不依赖胆盐的胆汗,胆盐的转运作用较弱。Ⅰ带和Ⅱ带肝细胞分泌的胆汁量较Ⅲ带的多。
除肝细胞的异质外,肝腺泡内的其他成分也表现一定的差异。如肝腺泡Ⅰ带的血窦窄而弯曲,表面积与腔容积之比较大,内皮细胞的窗孔也较大,故便于物质交换;Ⅲ带的血窦较直而宽,内皮细胞的窗孔小,血流易入中央静脉。肝腺泡Ⅰ带内的枯否细胞体积较大,数量较多,占肝内枯否细胞总数的43%,常首先摄进入肝血窦中的内源性或外源性异物;肝腺泡Ⅱ带和Ⅲ带内的枯否细胞数较少。肝腺泡Ⅰ带的贮脂细胞较多,细胞内含脂滴多;Ⅲ带的贮脂细胞较少,含脂滴也少。
(八)肝的再生
正常成体的肝细胞是一种长寿命细胞,极少见分裂相。但在肝受损害后,尤其在肝部分切除后,残余肝细胞迅速出现快速活跃的分裂增殖,并呈现明显的规律性。如大鼠肝被切除3/4后15~18小时,即以四倍体肝细胞为主启动增殖周期,术后24小时出现S期和G[XB]2[/XB]期高峰,术后36小时出现分裂高峰。术后2天内大多数肝细胞均至少分裂一次,此后肝细胞继续分裂增殖,直至术后5~7天肝恢复正常体积,肝细胞分裂也停止。肝病患者施行大部或部分肝切除后也有再生能力,但因病变情况而异,一般可在半年内恢复正常肝体积,肝具有如此强大的再生潜能,其机理虽已有许多研究,但迄今还不完全清楚。目前已知,肝再生受肝内外诸多因子的调控,包括肝细胞增殖刺激因子、肝细胞增殖抑制因子和激素类辅助因子三大类。肝细胞增殖刺激因子有数种,如表皮生长因子(EGF)、转化生长因子α(TGFα,肝大部切除后不久由新生肝细胞产生)、肝刺激物质(HSS,由再生肝产生)、肝细胞生长因子(HGF,由肺、肾、血小板等及受损害的肝产生)等。肝细胞增殖抑制因子也有几种,如转化生长因子β(TGFβ,由血小板和肝血窦内皮细胞等产生)、肝抑素(hepatic chalone),由正常肝细胞产生)等。激素类辅助因子,如胰岛素、高血糖素、生长激素等。在肝受损害或部分切除后,肝外和(或)肝内产生这些因子的量发生变化。它们通过肝细胞相应的受体作用于肝细胞,使肝细胞膜结构和代谢活动发生变化,启动和促进或抑制肝细胞的增殖。尽管上述因子的作用机理及其相互关系还不完全清楚,但它们协同调节和控制肝再生过程的事实已基本肯定。
