第三节 PCR操作范例及反应体系的组成
一、PCR操作范例
在一个典型的PCR反应体系中需加入:适宜的缓冲液、微量的模板DNA、4×dNTPs、耐热性多聚酶、Mg[SB]2+[/SB]和两个合成的DNA引物。模板DNa 94℃变性1min,引物与模板40~60℃退火1min,72℃延伸2min。在首次循环前模板预变性3~5min;在末次循环后,样品仍需继续延伸3~5min以上,确保扩增的DNA为双链DNA。为便于了解PCR反应中各成份的组成,加入量和反应条件,使人们以此为基础,对不同的研究对象逐项改变来找到最佳反应条件,特列举Perkin Elmer Cetus公司Gene Amp DNA试剂盒提供的典型反应条件供参考。
表22-1 PCR反应混合液
| 成分 | 加入体积(μl) | 最终浓度 |
| 双蒸馏水 | 53.5 | |
| 10×反应缓冲液[SB][1][/SB] | 10.0 | [1×]Mg[SB]2+[/SB]1.5mmol/l K[SB]+[/SB]50mmol/L |
| 4×dNTPs(各1.25mmol/L) | 16.0 | 各200μmol/L |
| λ-DNA模板(全长48.5kD) | 10.0 | 1ng/次 |
| 引物1,2(各25bp,20μmol/L)[SB][3,4][/SB] | 5.0 | 1.0μmol/L(100pmol) |
| Taq聚合酶储存液[SB][2][/SB] | 0.5 | 2U/100μl |
| 总体积(pH8.3) | 100.0 | |
| 石蜡油 | 50~100.0 |
扩增条件:94℃60s,37℃60s,72℃120s,共25~30个循环。
注:[1]反应缓冲液[10×]含:100mmol/l Tris-HCl pH8.3(25℃),
15mmol/L KCl, 15mmol/L MgCl[XB]2[/XB],
0.01%(W/V)明胶(Sigma G2500)
[2]酶储存缓冲液(-20℃)含:50%甘油,100mmol/l KCl,
20mmol/L Tris-HCl ph8.0
0.1mmol/L EDTA, 1.0mmol/L DTT
200μg/ml明胶
0.5%吐温20,0.5% Nonidet P40
[3][4]引物,1,2:扩增λ-噬菌体基因中500bp的片段
引物1序列:7131~7155(5’)-GATGAGTTCGTGTCCGTACAACTGG-(3’)
引物2序列:7606~7630(5’)-GGTTATCGAAATCAGCCACAGCGCC-(3’)
注意(3’)端有2个bp互补故易生成50bp的双体
二、PCR反应系统的组成
(一)PCR缓冲液(PCrBuffer)
用于PCR的标准缓冲液见PCR操作范例。于72℃时,反应体系的pH值将下降1个单位,接近于7.2。二价阳离子的存在至关重要,影响PCR的特异性和产量。实验表明,Mg[SB]2+[/SB]优于Mn[SB]2+[/SB],而Ca[SB]2+[/SB]无任何作用。
1.Mg[SB]2+[/SB]浓度Mg[SB]2+[/SB]的最佳浓度为1.5mmol/L(当各种dNTP浓度为200mmol/L时),但并非对任何一种模板与引物的结合都是最佳的。首次使用靶序列和引物结合时,都要把Mg[SB]2+[/SB]浓度调到最佳,其浓度变化范围为1~10mmol/L。Mg[SB]2+[/SB]过量易生成非特异性扩增产物,Mg[SB]2+[/SB]不足易使产量降低。
样品中存在的较高浓度的螯合剂如EDTA或高浓度带负电荷的离子基团如磷酸根,会与Mg[SB]2+[/SB]结合而降低Mg[SB]2+[/SB]有效浓度。因此,用作模板的DNA应溶于10mmol/l Tris-HCl(pH7.6)0.1mmol/L EDTA中。
dNTP含有磷酸根,其浓度变化将影响Mg[SB]2+[/SB]的有效浓度。标准反应体系中4×dTNPs的总浓度为0.8mmol/L,低于1.5mmol/L的Mg[SB]2+[/SB]浓度。因此,在高浓度DNA及dNTP条件时,必须相应调整Mg[SB]2+[/SB]的浓度。
2.Tris -HCl缓冲液在PCR中使用10~50mmol/L的Tris –HCl缓冲液,很少使用其他类型的缓冲液。Tris缓冲液是一种双极化的离子缓冲液,pKa为8.3(20℃),△pKa为0.021/℃。因此,20mmol/l Tris pH8.3(20℃)时,在典型的热循环条件下,真正的pH值在7.8~6.8之间。
3.KCl浓度K[SB]+[/SB]浓度在50mmol/L 时能促进引物退火。但现在的研究表明,NaCl浓度在50mmol/L时,KCl浓度高于50mmol/L将会抑制Taq酶的活性,少加或不加KCl对PCR结果没有太大影响。
4.明胶明胶和BSA或非离子型去垢剂具有稳定酶的作用。一般用量为100μg/ml,但现在的研究表明,加或不加都能得到良好和PCR结果,影响不大。
5.二甲基亚砜(DMSO)在使用Klenow片段进行PCR时DMSO是有用的;加入10%DM-SO有利于减少DNA的二级结构,使(G+C)%含量高的模板易于完全变性,在反应体系中加入DMSO使PCR产物直接测序更易进行,但超过10%时会抑制Taq DNA聚合酶的活性,因此,大多数并不使用DMSO。
(二)四种脱氧三磷酸核苷酸(4×dNTPs)
在PCR反体系中dNTP终浓度高于50mmol/L会抑制Taq酶的活性,使用低浓度dNTP可以减少在非靶位置启动和延伸时核苷酸错误掺入,高浓度dNTPs易产生错误掺入,而浓度太低,势必降低反应物的产量。PCR常用的浓度为50~200μmol/L,不能低于10~15μmol/L。四种dNTP的浓度应相同,其中任何一种浓度偏高或偏低,都会诱导聚合酶的错误掺入,降低合成速度,过早终止反应。
决定最低dNTP浓度的因素是靶序列DNA的长度和组成,例如,在100μl反应体系中,4×dNTPs浓度若用20μmol/L,基本满足合成2.6μg DNA或10pmol的400bp序列。50μmol/L的4×dNTPs可以合成6.6μgDNA,而200μmol/L足以合成25μg/DNA。
购自厂商的dNTP溶液一般均未调pH,应用1mol/l NaOH将dNTP贮存液pH调至7.0,以保证反应的pH值不低于7.1。市购的游离核苷酸冻干粉,溶解后要用NaOH中和,再用紫外分光光度计定量。
(三)引物的量
引物在PCR反应中的浓度一般在0.1~1μmol/L之间。浓度过高易形成引物二聚体且产生非特异性产物。一般来说用低浓度引物经济、特异,但浓度过低,不足以完成30个循环的扩增反应,则会降低PCR的产率。
(四)TaqDNA聚合酶的量
典型PCR反应混合物中,所用酶浓度为2.5U/μl,常用范围为1~4U/100μl。由于DNA模板的不同和引物不同,以及其它条件的差异,多聚酶的用量亦有差异,酶量过多会导致非特异产物的增加。
由于生产厂家所用兵配方、制造条件以及活性定义不同,不同厂商供应的TaqDNA聚合酶性能也有所不同。
Cetus公司酶定义是:1个酶单位是指在以下分析条件下,于74℃,30min内使10nmmol的dNTP掺入酸不溶性成分所需的酶。测定时间为10min,折算成30min掺入量。
分析条件为25nmol/L TAPS(三羟基-甲基-氨基丙烷磺酸钠pH9.3,25℃),50mmol/l KCl, 2mmol/L MgCl[XB]2[/XB],1mmol/L β-ME(巯基乙醇),dATP、dTTP、dGTP各200mmol/L,dCTP为100mmol/L(由不标记及α-[SB]32[/SB]P标记混合),12.μg变性鲱鱼精子DNA,最终体积50μl。
(五)模板
单、双链DNA或RNA都可以作为PCR的样品。若起始材料是RNA,须先通过逆转录得到第一条cDNA。虽然PCR可以仅用极微量的样品,甚至是来自单一细胞的DNA,但为了保证反应的特异性,还应用ng级的克隆DNA,μg水平的单拷贝染色体DNA或10[SB]4[/SB]拷贝的待扩增片段作为起始材料,模板可以是粗品,但不能混有任何蛋白酶、核酸酶、Taq DNA聚合酶抑制剂以及能结合DNA的蛋白。
DNA的大小并不是关键的因素,但当使用极高分子量的DNA(如基因组的DNA时),如用超声处理或用切点罕见的限制酶(如Sal[XB]1[/XB]和Not[XB]1[/XB])先行消化,则扩增效果更好。闭环靶序列DNA的扩增效率略低于线状DNA,因此,用质粒作反应模板时最好先将其线状化。
模板靶序列的浓度因情况而异,往往非实验人员所控制,实验可按已知靶序列量逆减的方式(1ng,0.1ng,0.001ng等),设置一组对照反应,以检测扩增反应的灵敏度是否符合要求。
(六)石蜡油
PCR扩增时建议在混合物上面铺一层石蜡油,减少PCR过程中尤其是变性时液体蒸发所造成的产物的丢失。研究表明,应用石蜡油可使扩增产量增加5倍,可能与石蜡油维持热恒定和整个反应体系中盐浓度有关。
三、电泳分析
在实际工作中常采用琼脂糖凝胶电泳。一般情况下先在电泳缓冲液或凝胶中加1%溴化乙锭(EB)(每100ml加100μl),然后将已经制备好的1%~2%琼脂糖凝胶(用电泳缓冲液配制)放入电泳槽内,加入待测样品10μl,同时用分子量标准品作标记。琼脂糖浓度应按分离DNA片段的大小进行选择,一般用1.5%~2%,电泳电压75V,待样品进行凝胶内距胶末端1cm时,切断电源,取出凝胶在紫外灯下直接观察结果。
由于溴化乙锭可与双链DNA形成结合物,在紫外灯下能发射荧光,使EB的荧光强度增强80~100倍,所以,电泳后凝胶在紫外灯下可直接观察。一般肉眼观察DNA量可达10ng,其荧光强度与DNA含量成正比。
DNA分子在凝胶中泳动速度决定于电荷效应及分子效应。前者由所带净电荷量决定,而后者与分子大小及构型有关。按照DNA分子大小,其凝胶浓度可做不同的调整。有条件的实验室也可用聚丙烯酰胺凝胶电泳(PAGE)分析扩增的DNA片段。
表22-2 电泳检测扩增结果,EB荧光显色(254nm)
| 琼脂糖(%) | kb | PAGR(%) | bp |
| 0.3 | 60~5 | 3.5 | 100~1000 |
| 0.6 | 20~1 | ||
| 0.7 | 10~0.8 | 5.0 | 80~500 |
| 0.9 | 7~0.5 | 8.0 | 60~400 |
| 1.2 | 6~0.4 | 12.0 | 40~200 |
| 1.5 | 4~0.2 | 20.0 |
第四节 影响PCR的主要因素
PCR技术必须有人工合成的合理引物和提取的样品DNA,然后才进行自动热循环,最后进行产物鉴定与分析。引物设计与合成目前只能在少数技术力量较强的研究院、所进行,临床应用只需购买PCR检测试剂盒就可开展工作,PCR自动热循环中影响因素很多,对不同的DNA样品,PCR反应中各种成份加入量和温度循环参数均不一致。现将几种主要影响因素介绍如下。
一、温度循环参数
在PCR自动热循环中,最关键的因素是变性与退火的温度。如操作范例所示,其变性、退火、延伸的条件是:94℃60s, 37℃60s, 72℃120s,共25~30个循环,扩增片段500bp。在这里,每一步的时间应从反应混合液达到所要求的温度后开始计算。在自动热循环仪内由混合液原温度变至所要求温度的时间需要30~60s,这一迟滞时间的长短取决于几个因素,包括反应管类型、壁厚、反应混合液体积、热源(水浴或加热块)以及两步骤间的温度差,在设置热循环时应充分给以重视和考虑,对每一仪器均应进行实测。
关于热循环时间的另一个重要考虑是两条引物之间的距离;距离越远,合成靶序列全长所需的时间也越长,前文给出的反应时间是按最适于合成长度500bp的靶序列拟定的。下面就各种温度的选择作一介绍。
1.模板变性温度变性温度是决定PCR反应中双链DNA解链的温度,达不到变性温度就不会产生单链DNA模板,PCR也就不会启动。变性温度低则变性不完全,DNA双链会很快复性,因而减少产量。一般取90~95℃。样品一旦到达此温度宜迅速冷却到退火温度。DNA变性只需要几秒种,时间过久没有必要;反之,在高温时间应尽量缩短,以保持Taq DNA聚合酶的活力,加入Taq DNA聚合酶后最高变性温度不宜超过95℃。
2.引物退火温度退火温度决定PCR特异性与产量;温度高特异性强,但过高则引物不能与模板牢固结合,DNA扩增效率下降;温度低产量高,但过低可造成引物与模板错配,非特异性产物增加。一般先由37℃反应条件开始,设置一系列对照反应,以确定某一特定反应的最适退火温度。也可根据引物的(G+C)%含量进行推测,把握试验的起始点,一般试验中退火温度Ta(annealing temperature)比扩增引物的融解温度TTm(meltingtemperature)低5℃,可按公式进行计算:
Ta = Tm -5℃= 4(G+C)+ 2(A+T)-5℃
其中A,T,G,C分别表示相应碱基的个数。例如,20个碱基的引物,如果(G+C)%含量为50%时,则Ta的起点可设在55℃。在典型的引物浓度时(如0.2μmol/L),退火反应数秒即可完成,长时间退火没有必要。
3.引物延伸温度温度的选择取决于Taq DNA聚合酶的最适温度。一般取70~75℃,在72℃时酶催化核苷酸的标准速率可达35~100个核苷酸/秒。每分钟可延伸1kb的长度,其速度取决于缓冲溶液的组成、pH值、盐浓度与DNA模板的性质。扩增片段如短于150bp,则可省略延伸这一步,而成为双温循环,因Taq DNA聚合酶在退火温度下足以完成短序列的合成。对于100~300bp之间的短序列片段,采用快速、简便的双温循环是行之有效的。此时,引物延伸温度与退火温度相同。对于1kb以上的DNA片段,可根据片段长度将延伸时间控制在1~7min,与此同时,在PCR缓冲液中需加入明胶或BSA试剂,使Taq DNA聚合酶在长时间内保持良好的活性与稳定性;15%~20%的甘油有助于扩增2.5kb左右或较长DNA片段。
4.循环次数常规PCR一般为25~40个周期。一般的错误是循环次数过多,非特异性背景严重,复杂度增加。当然循环反应的次数太少,则产率偏低。所以,在保证产物得率前提下,应尽量减少循环次数。
扩增结束后,样品冷却并置4℃保存。
二、引物引物设计
要扩增模板DNA,首先要设计两条寡核苷酸引物,所谓引物,实际上就是两段与待扩增靶DNA序列互补的寡核苷酸片段,两引物间距离决定扩增片段的长度,两引物的5’端决定扩增产物的两个5’末端位置。由此可见,引物是决定PCR扩增片段长度、位置和结果的关键,引物设计也就更为重要。
引物设计的必要条件是与引物互补的靶DNA序列必须是已知的,两引物之间的序列未必清楚,这两段已知序列一般为15~20个碱基,可以用DNA合成仪合成与其对应互补的二条引物,除此之外,引物设计一般遵循的原则包括:
1.引物长度根据统计学计算,长约17个碱基的寡核苷酸序列在人的基因组中可能出现的机率的为1次。因此,引物长度一般最低不少于16个核苷酸,而最高不超过30个核苷酸,最佳长度为20~24个核苷酸。这样短的寡核苷酸在聚合反应温度(通过72℃)下不会形成稳定的杂合体。有时可在5’端添加不与模板互补的序列,如限制性酶切位点或启动因子等,以完成基因克隆和其他特殊需要;引物5’端生物素标记或荧光标记可用于微生物检测等各种目的。
有时引物不起作用,理由不明,可移动位置来解决。
2.(G+C)%含量引物的组成应均匀,尽量避免含有相同的碱基多聚体。两个引物中(G+C)%含量应尽量相似,在已知扩增片段(G+C)%含量时宜接近于待扩增片段,一般以40%~60%为佳。
3.引物内部应避免内部形成明显的次级结构,尤其是发夹结构(hairpinstructures)。例如:
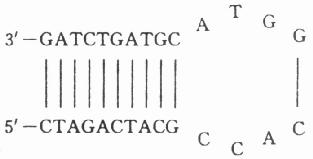
4.引物之间两个引物之间不应发生互补,特别是在引物3’端,即使无法避免,其3’端互补碱基也不应大于2个碱基,否则易生成“引物二聚体”或“引物二倍体”(Primer dimer)。所谓引物二聚体实质上是在DNA聚合酶作用下,一条引物在另一条引物序列上进行延伸所形成的与二条引物长度相近的双链DNA片段,是PCR常见的副产品,有时甚至成为主要产物。
另外,两条引物之间避免有同源序列,尤为连续6个以上相同碱基的寡核苷酸片段,否则两条引物会相互竞争模板的同一位点;同样,引物与待扩增靶DNA或样品DNA的其它序列也不能存在6个以上碱基的同源序列。否则,引物就会与其它位点结合,使特异扩增减少,非特异扩增增加。
5.引物3’端配对DNA聚合酶是在引物3’端添加单核苷酸,所以,引物3’端5~6个碱基与靶DNA的配对要求必须精确和严格,这样才能保证PCR有效扩增。
引物设计是否合理可用PCRDESN软件和美国PRIMER软件进行计算机检索来核定。
人工合成的寡核苷酸引于最好经过色谱(层析)纯化或PAGE纯化,以除去未能合成至全长的短链等杂质。纯化引物在25%乙腈溶液中4℃保存可阻止微生物的生长;一般情况下,不用的引物应保存在-20℃冰箱中,在液体中引物能保存6个月,冻干后可保存1~2年。
三、DNA聚合酶
早在1956年Kornberg等就从大肠杆菌提取液中发现了DNA聚合酶,并且得到了DNA聚合酶Ⅰ纯品。DNA聚合酶Ⅰ是由分子量为109000的一条多肽链构成,此酶可被枯草杆菌蛋白酶分解为两个片段,一个片段分子量为76000,有聚合酶活性,并有3’→5外切酶活力,即Klenow片段(Klenow fragment)。另一个片段分子量为34000,具有5’→’3’外切酶活力。因此,DNA聚合酶具有几种功能:一是聚合作用,以DNA为模板,将dNTP中的脱氧单核苷酸逐个加到3-OH末端。二是有’3’→5’外切酶活力,能识别和消除错配的引物末端,与复制过程中校正功能有关。三是5’→3’外切酶活力,它能从5’端水解核苷酸,还能经过几个核苷酸起作用,切除错配的核苷酸。1985年Mullis 等发明了PCR方法,以Klenow片段完成β-珠蛋白的PCR后,世界上许多实验室就考虑用耐热DNA聚合酶代替Klenow片段进行PCR,使耐热多聚酶的研究得以迅速发展。人们从生活于60℃(B.Stearothermophilus)到87℃(S.Solfatavicus)的许多菌中分离纯化出耐热DNA聚合酶,但有些酶不能耐受DNA变性所需温度,所以无法应用于PCR。现就PCR反应中常用的DNA聚合酶等作一详细介绍。
1.Taq DNA聚合酶用Taq DNA聚合酶代替大肠杆菌DNA聚合酶Ⅰ的Klenow片段是使PCR普及应用的关键。Klenow片段不能耐受95℃的双链DNA变性温度,所以每次循环都要加入新酶;而Taq DNA聚合酶可以耐受93~95℃的高温,避免了不断补加多聚酶的繁琐操作,同时使退火和延伸温度得以提高,减少了非特异性产物和DNA二级结构对PCR的干扰,增进了PCR特异性、产量和敏感度,二者相比,其主要区别在于:①Klenow酶的最适温度为37℃,扩增的产物并非全是目的序列,需用探针检测。Taq酶则不仅产率高而特异性也高。它的最适温度为74~75℃。因而使退火温度可以提高,使退火严格性提高,减少错配引物的延伸。②循环后期酶量渐感不足而产生平坡。到达平玻的循环次数,Klenow酶为20个(均用1μg基因组DNA开始)而Taq酶为30个。③延伸片段长度Taq酶为10kb以内,而Klenow酶为400bp以内。
Taq酶由水栖高温菌(Thermusaquatics)YT1蓖株中分离而得。此菌于1969年由Brock分离自美国黄石公园温泉,作为栖热杆菌的标准菌株,其生长温度为70~75℃。最初从中分离到分子量60~68KDa,比活性为2000~8000U/mg的DNA聚合酶。后来Cetus公司的Kary Mullis等又分离到比活为20万U/mg的纯酶,分子量为93910。此种9.4KDa酶的最适温度为75~80℃,与单纯核苷酸的结合率(Kcat)可达150核苷酸(nt)/s酶分子。以M[XB]13[/XB]模板,用富含G+C的30bp引物延伸,70℃时Kact>60nt/s;55℃可达24nt/s;37℃时为1.5nt/s,而22℃时低至0.25nt/s。高于90℃时DNA合成活性甚差,这种高温条件下,引物与模板已不能牢固结合。
在PCR反应混合液中,Taq酶于92.5℃,95℃及97.5℃保持其50%活力的时间分别为130、40及5~6min,在50次循环的PCR中当管内最高温度为95℃。每循环为20s时尚可保持65%活力。Taq 酶在95℃的半寿期为40min,故在PCR循环中选用的变性温度,不宜高于95℃。
Taq酶现已可用基因重组的方法生产,商品名为Ampli Taq(Cetus公司)。Taq酶的完整基因长2499bp,在大肠杆菌中表达生产,含832个氨基酸。在氨基酸序列上与大肠杆菌DNA聚合酶Ⅰ有38%是一致的,包括对dNTP结合,引物与模板作用区均存在于Taq酶中。
Taq酶具有依赖DNA合成的5’→’3’外切酶活性,因此,模板上有一段退火的3’-磷酸化的“阻断物”,会被逐个切除而不会阻止来自上游引物链的延伸,而对于5’-[SB]32[/SB]P标记的合成寡核苷酸引物,则无论是单链或是与模板复性,都未发现降解,所以该种活性不会影响PCR结果。Taq酶没有3’→’5’外切酶活性,如果发生dNTP错误掺入,这种酶没有校正能力,因此运用Taq酶进行PCR,产物中点突变较多,对克隆等不太有利。一般错掺率为1.25×10[SB]-4[/SB]~1×10[SB]-5[/SB](4×dNTPs浓度分别为200μmol/L,Mg[SB]2+[/SB]为1.5mmol/L,在55℃退火)。但不含3’→5’外切酶活性对测序有利。
2.影响酶活力的因素Taq酶的活力受Mg[SB]2+[/SB]离子的影响。用鲱精DNA为模板,总dNTP浓度0.7~0.8mmol/L,Mg[SB]2+[/SB]为2.0mmol/L时激活能力最高。浓度超过此值产生抑制。10mmol/l MgCl[XB]2[/XB]抑制活力达40%~50%。dNTP能与Mg[SB]2+[/SB]结合,故游离Mg[SB]2+[/SB]只是结合后剩余的量。若总dNTP浓度高至4~6mmol/L时,Taq酶活力要降低20~30%,即底物抑制。
dNTP浓度低时PCR产率及特异性均增高,适合于用扩增掺入法标记生物素及放射性元素。当100μl PCR液中含dNTP各40μmol/L时就足以合成2.6μg的DNA(dNTP消耗一半)。
表22-3 有机溶剂对Taq聚合酶活力的影响
| 物质 | 浓度 | 活力(%) |
| 乙醇 | <3% | 100 |
| 10% | 110 | |
| 尿素 | <0.5mol/L | 100 |
| 1.0mol/L | 118 | |
| 1.5mol/L | 107 | |
| DMSO | <1% | 100 |
| 10% | 53 | |
| 20% | 11 | |
| 二甲基甲酰胺 | <5% | 100 |
| 10% | 82 | |
| 20% | 17 | |
| 甲酰胺 | <10% | 100 |
| 15% | 86 | |
| 20% | 39 | |
| SDS | 0.001% | 105 |
| 0.01% | 10 | |
| 0.1% | <0.1% |
用鲱精DNA,70℃,10min内dNTP的掺入量计算,标准条件为100%。
纯9.4KDa Taq酶不含3’→5’核酸外切酶活力。误掺入率取决于dNTP浓度。但Taq酶具有DNA依赖的链移位5’→3’核酸外切酶活力。对5’→3’[SB]32[/SB]P标记寡核苷酸单链,或与MB模板杂交时均只有极少的降解力。
中等浓度KCl能刺激Taq酶合成活力达50%~60%,最佳KCl浓度为50mmol/L,浓度更高有抑制作用,>200mmol/L的KCl可使酶失活。
加入50mmol/L NH[XB]4[/XB]Cl或NH[XB]4[/XB]Ac或NaCl,可产生中度抑制或无作用。
低浓度尿素、DMSO、DMF或甲酰胺影响不大,吐温20/NP40可消除SDS(0.01%及0.1%)的抑制作用。
3.第二代耐热DNA聚合酶Stoffel片段:Cetus公司的Stoffel将TaqDNA聚合酶的5’→3’外切酶活性片段(N端289个氨基酸)去除,称为stoffel片段。其97.5℃的半衰期从Taq DNA聚合酶的5~6min提高到20min,同时该酶片段也对两个或更多模板位点的扩增反应即复合PCR(Multiplex PCR)更为有利。
Vent[SB]TM[/SB]DNA多聚酶:是美国New England Biolabs公司从潜水艇排气孔(Vent)中分离的超级嗜热菌-能生长于98℃中的Thermococcus litoralis中分离纯化得到的,故名Vent酶。它的一些酶学性质较Taq DNA聚合酶更为优越,它能耐100℃高温且2h以上仍有活力,并且具有3’→5’外切酶活性的校正能力,错误扩增的机率比Taq酶降低一倍。后来该公司又从深水潜艇(2010m)排气孔分离的能在104℃生长的Pyococcus菌GB-D株植入Deep Vent DNA聚合酶基因而表达的Deep Vent DNA聚合酶,在95℃的半寿期达23h(Vent酶为6.7h,Taq酶为1h)。
4.RTth逆转录酶(rTth Reverse Transcriptase)目前逆转录-PCR(RT-PCR)的发展很快,所以对耐热的依赖于RNA的DNA多聚酶的研究也有进展。有实验表明Taq DNA多聚酶有依赖于RNA的DNA聚合酶活性,但活性较弱。Cetus公司于1991年推出一种rTth Reverse Tran-scriptase,有很好的依赖于RNA的耐热DNA聚合酶活性和依赖于DNA的耐热DNA聚合酶活性,二种活性分别依赖于Mn[SB]2+[/SB]Mg[SB]2+[/SB],这样就可分别控制酶活性。利用该酶只需250ng的总RNA即可有效地进行RT-PCR,得到特异的DNA片段,从而非常有利于逆转录PCR的发展。
耐热DNA聚合酶的研究近几年来得到长足的发展,这在PCR发展中起到了重要的作用。我们相信随着进一步的研究,将使人们对耐热DNA聚合酶的认识和应用更进一步地发展。
我国的PCR研究发展很快,其关键试剂-耐热DNA聚合酶-也已有几个实验室能够分离纯化,如复旦大学遗传学研究所、华美公司、中国医学科学院基础医学研究所。后二者的菌株为Thermus aquaticus YT-1。前者则是从自己筛选的嗜热菌中分离纯化,复旦大学遗传所亦已成功地克隆了该聚合酶的基因并获得了耐热F[XB]4[/XB]DNA聚合酶,其酶学性质非常接近于Taq DNA聚合酶,为我国PCR的开展提供了保证。
四、影响PCR特异性的因素
通过上述内容。可以看出有许多因素可以影响PCR的特异性,在此我们作一归纳,供大家参考:①退火步骤的严格性:提高退火温度可以减少不匹配的杂交,从而提高特异性。②减短退火时间及延伸时间可以减少错误引发及错误延伸。③引物二聚体是最常见的副产品,降低引物及酶的浓度也可以减少错误引发,尤其是引物的二聚化。④改变MgCl[XB]2[/XB](有时KCl)浓度可以改进特异性,这可能是提高反应严格性或者对Taq酶的直接作用。⑤模板中如果存在次级结构,例如待扩增的片段易自行形成发夹结构时,可在PCR混合物中的4×dNTPs中加入7-脱氮-2’-脱氧鸟苷-5’-三磷酸(7-deaza-2’-deoxyguanosine-5’-trihosphate)(de[SB]7[/SB]GTP)。用de[SB]7[/SB]GTP与dGTP比例为3:1的混合物(150μmol/l de[SB]7[/SB]GTP +50μmol/L dGTP)代替200μmol/l dGTP,则可阻非特异性产物的生成。
五、扩增平坡
扩增反应并不是可以无穷地进行下去的,经过一定的循环周期后需扩增的片段不再按指数增多而逐渐进入平坡;进入平坡的循环次数,取决于起始时存在的模板拷贝数以及合成的DNA总量。所谓平坡就是批PCR循环的后期,合成产物达0.3~1pmol时,由于产物的堆积,使原来以指数增加的速率变成平坦的曲线。
造成PCR进入平坡的原因有:引物和dNTP等消耗完毕、Taq酶失活,这几中因素在标准反应中均不会出现。此外,还有几种可能:
1.底物过剩因DNA合成量多于反应液中存在的Taq酶,在100μl反应液中含2.5Utaq酶而DNA合成量达1μg(3nmol脱氧核苷酸)时,开始变为底物过剩。延长延伸时间或添加Taq酶,可以克服之。但不实用,因每进行下一循环就要延长延伸时间一倍及多加一倍Taq酶,才能继续保持指数增长。
2.非特异性扩增产物的竞争与上述情况密切相关,此时不需要的DNA片段与需要的片段同时竞争聚合酶,要克服这一情况是要提高反应特异性,使不需要片段不能大量积聚。
3.退火时产物的单链自己缔合两条单链的DNA片段在退火时除了与引物缔合外,也可以自行缔合,这也会阻止产品增多。当产物浓度到达10pmol/100μl时即可发生此现象,除稀释外无法克服。
4.变性在高浓度产物条件下,产物解链不完全,以及最终产物的阻化作用(焦磷酸化,双链DNA)。
总而言之,PCR的条件是随系统的而异的,并无统一的最佳条件,先选用通用的条件扩增,然后稍稍改变各参数,可以达到优化,以取得优良的特异性和产率。
