第二节 乙型肝炎病毒
1963年Blumberq在两名多次接受输血治疗的病人血清中,发现一种异常的抗体,它能与一名澳大利亚土著人的血清起沉淀反应。直到1967年才明确这种抗原与乙型肝炎(简称乙肝)有关,1970年在电子显微镜下观察到HBV的形态,1986年将其列入嗜肝DNA病毒科。
一、生物学性状
(一)形态与结构
1.大球形颗粒:亦称Dane颗粒,它是一种由一个囊膜和一个含有DNA分子的核衣壳组成的病毒颗粒,直径约42nm。核衣壳为20面体对称结构。游离的核衣壳只能在肝细胞核内观察到。血中Dane颗粒浓度以急性肝炎潜伏期后期为最高,在疾病起始后则迅速下降。 Dane颗粒表面含有HBsAg ,核心中还含有双股有缺口的DNA链和依赖DNA的DNA多聚酶。目前认为Dane颗粒即完整的HBV(图26-1)。
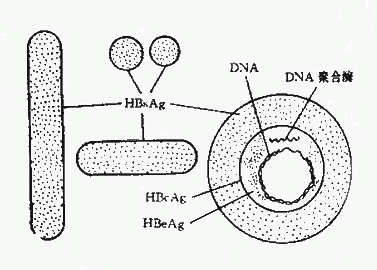
图26-1 HBV病毒颗粒图示
HBV DNA的两链长短不一,长链(L)完整,为负链,长度恒定,约3200个核苷酸。短链(S)为正链,长度可变,约为长链长度的50~100%,链的增生按5′-3′顺序进行。在不同分子中短链3′端的位置是可变的,而短链和长链的5′端位置固定点为粘性末端,通过250~300个核苷酸碱基配对,以维持DNA分子的环状结构。在粘性末端两侧,两链5′端各有一个由11个bp组成的直接重复序列(Direct repeat DR)-5′TTCACCTCTCC,该DR位于第1824个核苷酸者称DR1,位于第1590个核苷酸者称DR2,在病毒复制中起作用。
2.小形球颗粒:直径约22nm的小球形颗粒是HBV感染后血液中最多见的一种。它由HBsAg,即病毒的囊膜组成。化学组成为脂蛋白,可按其特有的密度与正常血清蛋白部分分离。在此颗粒中未检出达DNA多聚酶活性。目前认为HBV的小颗粒不是HBV,可能是它感染肝细胞时合成过剩的囊膜而游离于血循环中。
3.管形颗粒:直径约22nm,长度可在100~700nm之间。实际上它是一串聚合起来的小颗粒,但同样具有HBsAg的抗原性。
(二)基因结构
目前,已可从感染HBV病人的血清中及感染肝脏提纯的病毒核心中分离出环状双股DNA,从而确定HBV属DNA病毒。
研究Dane颗粒DNA结构发现,DNA分子含有约3,200个核苷酸。它包括两个链;一个长度固定的负链和另一长度不定的正链。由于DNA生物合成是在多聚酶作用DNA引物生长末端3′-OH与加入的脱氧核苷酸的5'-磷酸基形成磷酸二脂键完成的,因此,链的增生按5'-3'顺序进行,而且加到链上的每种脱氧核苷酸是按模板DNA的碱基配对互补规律进行,长链在1,800或1,818核苷酸附近有一个制品。短链的5'-末端通过长达250-300个核苷酸的碱基配对而维持分子的环状结构。DNA多聚酶作用不断延长短链3′端以修补缺口。缺口可能与HBV的DNA在感染细胞内的整合有关。
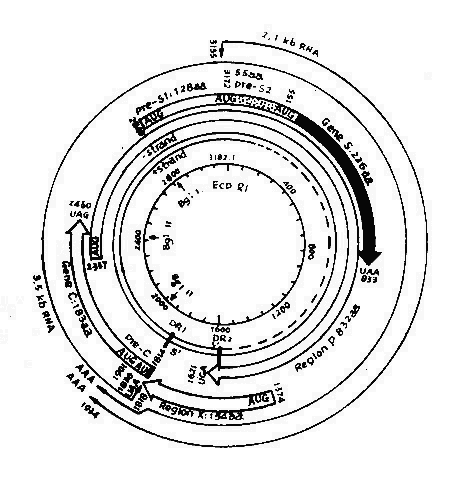
图26-2 HBV病毒基因图示
目前,由于克隆化DNA完整核苷酸已经确定,现已证实HBsAg和HBcAg都是由Dane颗粒的DNA所编码,并且二类基因存在同一DNA分子上。有人比较病毒基因编码能力和病毒多少,发现HBv DNA负链能编码全部已知的HBV蛋白质,而其正链开放读码区,不能编码病毒蛋白。
HBV DNA负链有四个开放区,分别称为S、C、P及X(图26-2),能编码全部已知的HBV蛋白质。S区可分为二部分,S基因和前S基因。S基因(核苷酸155~833)能编码主要表面蛋白。S基因之前是一个能编码163个氨基酸(2,848-154)的前S基因,编码Pre S1和Pre S2蛋白。C区基因包括前C基因和C基因,分别编码HBeAg和HBcAg。P区最长,约占基因组75%以上,编码病毒体DNA多聚酶。X区(核苷酸1,374~1,835)可能编码有154个氨基酸的碱性多肽,长链的裂口位于此区。
(三)HBV的抗原组成
1.HBsAg:HBsAg是由HBV的基因组所特定的,为上述三种形态的颗粒所共有。
HBsAg 抗原活性属于高浮力密度范围内的脂蛋白类。用CsCl密度梯度离心,表面抗原(小颗粒和管状颗粒)平均密度为1.20g/cm2。Dane颗粒的密度略高,为1.25g/cm2。纯化的22nm颗粒的平均沉降系数为33-54S,分子量约为24-2.5×106。
纯化的HBsAg 含有类脂质、糖类、脂质、蛋白质及糖蛋白。它由8种多肽组成,定名为P1至P8。其中至少有二种或三种多肽过碘酸Schiff试验阳性,提示存在糖类结构。用紫外分光光度计检查提取的HBsAg,显示有典型的蛋白吸收光谱。蛋白占总量的70~90%以上,广义的HBsAg 由三种蛋白组成:(1)主要表面蛋白(S蛋白,小分子HBsAg),由S基因编码的226个氨基酸组成。(2)中分子蛋白(中分子HBsAg),由前S2、S基因编码,在S蛋白226个氨基酸的N端附加一个含55个氨基酸的Pre S2蛋白组成,共281个氨基酸。(3)大分子蛋白(大分子HBsAg),由S,前S1和前S2基因编码,在中分子蛋白281个氨基酸的N端附加一个含119个氨基酸的PreS1蛋白组成,共400个氨基酸。
S蛋白即狭义HBsAg,是HBV囊膜的主要表面抗原的主要成份,包括糖基化的GP27和非糖基化的P24两种形式,以二硫键相连形成二聚体,代表HBsAg的结构单位,具备完整的抗原性。如二聚体解离,则HBsAg抗原性将会明显下降。
HBsAg 能刺激机体产生相应抗体—抗HBS,它是HBV的中和抗体,具有免疫保护作用,HBsAg的检出是HBV感染的标志之一。
前S蛋白2(Pre S2),的C端HBsAg端相连,Pre S2暴露于HBV囊膜外层,具有多聚人血清白蛋白 (Polymenized Human SerumAlbumin,PHSA)的受体(PHSA-R),能与PH-SA结合。由于肝细胞表面也有PHSA-R,HBV能通过血循环中存在的PHSA的介导,吸附到肝细胞表面,最后经胞饮作用进入肝细胞内。如病人血清中检出Pre S2,表示HBV在肝细胞中复制。PreS2有良好的免疫原性,能刺激机体产生相应抗体—抗Pre S2。此抗体出现于急性感染恢复早期,比抗HBs出现早而维持时间与抗HBs一样。抗PreS2具有中和作用,可作为机体康复的指标之一。
Pre S1有较强免疫原性,并能增强Pre S2和HBsAg 的免疫原性;Pre S1刺激机体产生相应抗体—Pre S1。该抗体有lgM和lgG两种,其中抗Pre S1在HBV感染潜伏期,也就是在抗HBV~lgM出现前已产生,故可作为HBV早期感染的特异性指标。而抗Pre S1 lgG出现稍晚,在体内维持时间较长,具有中和作用。
HBsAg对一些促进变性的化合物,如乙醚、1:1氯仿一尿素、十二烷基硫酸钠、吐温30以及各种蛋白水解酶都很稳定。HBsAg在酸性下孵育几小时仍很稳定。在碱性下,冷冻融化不能使其灭活。表面的类脂质可能对于一些主要由蛋白组成的抗原决定簇起保护作用。
HBsAg具有几种特异性抗原组分,包括各亚型共同抗原特异决定族a,和二组互相排斥的亚型决定簇d/y和 w/r。HBsAg的主要亚型有adr、adw、ayr及ayw4种。欧美各国adr、为主,我国汉族以adr居多中区地区及我国少数民族地区以ayw为主(西藏、新疆、内蒙等)。
2.HBcAg:HBcAg存在于Dane颗粒的核心和乙型肝炎患者的肝细胞核内。HBcAg一般从HBcAg阳性尸检肝或实验感染的黑猩猩肝脏提取。在乙型肝炎的急性期、恢复期和HBcAg携带者中常可测出抗~HBc。此抗体对病毒无中和作用。体内如发现HBcAg或抗~HBc表示HBV在肝内持续复制。
3.HBeAg:有关e抗原的本质还不十分清楚,但多数认为它是潜藏存在于Dane颗粒的核心部分。到目前为止,尚未在HbsAg阴性的血清中出现过。HBeAg是一种溶性抗原。抗原已知有三种亚型:e1,e2及e3。由于HBeAg与DNA多聚酶在血液中的消长相符,故HBcAg的存在可作为体内有HBV复制及血清具有传染性的一种标记,血中HBsAg滴度越高,HBeAg的检出率亦愈高。有些病人可出出现HBe抗体,可能也是一种有保护作用的抗体。
(四)HBV的培养
HBV的组织培养尚未成功。虽然近年来发展了从人胚肝获得的分化脓细胞初代培养、制备半连续人肝细胞系和诊断性肝穿刺培养的成人胚组织的方法,但应用各种肝组织在体外培养HBV仍很困难。尽管用各种细胞和器官分离HBV的大胆尝试,获得一些“肝炎待定”病毒,但难以使其在组织培养中连续传代,因而还没有一个被公认是HBV。近来用提取HBv DNA进行传染及通过细胞融合来拯救病毒的途径发离HBV,仍未得到公认的结果。
南非学者(1976)报道了从一个HBsAg阳性原发性肝癌组织建立的细胞系(PLC/PRF/5)中找到HBsAg的复制。此细胞系的主要特点是能产生HBsAg 逐日上升。104/日细胞可产生500ng HBsAg ,免疫电镜显示大多数为22nm的颗粒,均为圆形,略有亚微结构。其抗原性与免疫性均与血液中的HBsAg相同。未见有Dane颗粒及管形。目前,此细胞系已用于体外研究病毒基因组表达的有用模型。
黑猩猩是HBV的易感动物,狨猴虽可感染但不如前者敏感。国外用黑猩猩研究HBV的发病机理,检测自动免疫、被动免疫的效果以及HBV疫苗的安全性。但黑猩猩的来源短缺,难以广泛应用。
(五)抵抗力
HBV对外界的抵抗力较强。对低温、干燥、紫外线和一般化学消毒剂均耐受。乙肝病毒的传染性和HBsAg的抗原性在对外界抵抗力方面完全一致。二者在37℃活性能维持7天,在-20℃可保存20年,100℃加热10分钟可使HBV失去传染病,但仍可保持表面抗原活性。HBV对0.5%过氧乙酸、5%氯酸钠和3%漂白粉敏感,可用它们来消毒。
二、HBV的致病性与免疫性
(一)传染源与传播途径
乙肝的主要传染源是病人和HBV抗原携带者。在潜伏期和急性期,病人血清均有传染性。乙型肝炎的传播非常广泛,据估计HBsAg携带者在世界上约有2亿。由于他们不显临床症状,而HBsAg携带的时间又长(数月至数年),故成为传染源的危害性要比患者更大。
HBV的传染性很强,据报道,接种0.00004ml含病毒的血液足以使人发生感染。输血或注射是重要的传染途径,也可口感染。外科和口腔手术、针剌、使用公用剃刀、牙刷等物品,皮肤微小操作污染含少量病毒的血液,均可成为传染源。通过呼血吸昆虫传染乙型肝炎亦有报道。近来有人报告在急性乙型肝炎患者和慢性HBsAg携带者唾液标本中检测到HBsAg及Dane颗粒,因此,HBsAg随唾液经口传播的途径应当重视。孕妇在妊娠后期患急性乙型肝炎,其新生儿容易感染此病。由于乙型肝炎容易感染此病。由于乙型肝炎患者和HBsAg携带者的精液、阴道分泌物均可检出HBsAg ,因此,两性接触传播乙型肝炎的可能性是存在的。
(二)致病机理与免疫性
HBV的致病机理尚未完全明了。鉴于乙肝临床类型可表现为多种多样(如急性肝炎、慢性活动性肝炎、慢性迁延性肝炎、重症肝炎及HBsAg无症状携带者),因而认为HBV的致病作用一般病毒不同。可能不是由于病毒在夺细胞内增殖而直接损害靶细胞,而很可能系通过机体对病毒的免疫反应而引起病变和症状。
1.特异性抗体:受乙肝病毒感染后,机体可产生三种抗体,抗HBs、抗HBc 及抗HBe。抗HBs一般在感染HBV后4周出现,对乙肝有保护作用。据报道,在712名医务人员中,有抗—HBs者发生乙肝的不到1%,而无抗—HBs者有11%发生肝炎。但抗HBs仅能作用于细胞外的HBV,在预防感染上较重要,而在疾病恢复时尚需细胞免疫协同作用。
抗HBc的出现反映了HBV新近感染及正在体内进行增殖,因此,它可用为HBV在体内复制的一个指标。抗HBc一般在感染后60~150天出现,往往在症状出现前或出现不久后即存在,比抗HBs出现要早31~87天,但不如抗~HBc存在持久。抗~HBc与肝中HBcAg量有关,慢性HBsAg携带者抗HBc滴度较低,慢肝活动期、肝硬化及肝癌患者则较高。滴度波动与病情呈平行关系,由于抗HBc在疾病恢复过程中不仅不升高、反而下降,因此,认为抗HBc与抗HBs不同,它与保护无关,而与病毒增殖和肝细胞损害有关。
抗Hbe能使病毒活力降低,可能有保护作用,但机制不一样。
2.免疫复合物的损伤作用:在乙型肝炎病人血循环中常可测出HBsAg—抗HBs的免疫复合物。免疫复合物可引起Ⅲ型变态反应,其中以关节炎和肾炎最为常见。在暴发性肝炎病从血中有时也可同时测HBsAg—抗HBs,这种病人预后不良,死亡率高。因此,认为免疫复合物可在肝外引起病人的一系列症状。如大量免疫复合物急性沉着于肝内,致毛细血管栓塞,则可能引起急性肝坏死而导致死亡。
3.细胞介导的免疫反应:目前认为HBV是非溶细胞性的,即不会增殖裂解被感染的细胞。因此,机体清除乙肝病毒主要依赖T细胞(Tc,T杀伤细胞)或通过抗体介导的K细胞来杀伤靶细胞,将病毒释放于体液中,以后再经抗体作用。实验研究发现,凡转为慢性肝炎者,一般T细胞数及功能较低下。因此,推测可能乙型肝炎病人T细胞功能强弱与临床过程的轻重和转归有关。Dudleuy认为,当T细胞免疫功能正常,受病毒感染的肝细胞不多时,乙肝病毒很快被细胞免疫配合体液免疫予以清除,这时,由细胞免疫所造成的急性肝细胞损伤可完全恢复。如T细胞免疫功能低下,免疫反应不足以完全破坏被病毒感染的肝细胞,或亦不能产生有效的抗HBs,或即使抗HBs却无法作用于细胞内的病毒,持续在肝细胞内的病毒可引起免疫病理反应而导致慢性持续性肝炎。如机体对病毒完全缺乏细胞免疫反应,既不能有效地清除病毒,亦不导致免疫病理反应,结果出现HBsAg 无症状携带症状。如果T细胞免疫功能过强,病毒感染的细胞又过多,细胞免疫反应可迅速引起大量肝细胞坏死,临床上表现为暴发性肝炎。但上述学说尚未被完全证实,通过进一步的研究,多数人认为细胞免疫和体液免疫相互配合发挥免疫作用。因此,抗体介导的K细胞作用已日益受到重视,并认为是杀伤靶细胞的重要免疫机制。除上述T细胞作用低下外,还有人认为慢性活动性肝炎的发生与T细胞抑制性功能低下,Tc细胞或K细胞的杀伤功能过强有关,从而造成肝细胞持续损伤。
4.自身免疫反应:HBV感染肝细胞后,一方面可引起肝细胞表面抗原的改变,暴露出膜上的肝特异蛋白抗原(Liver specific protein:;LSP),另一方面可能因HBsAg含有与宿主肝细胞蛋白相同的抗原,从而诱导机体产生对肝细胞膜抗原成份的自身免疫反应。通过研究,发现确有部分乙肝病人存在对LSP的特异抗体或细胞免疫反应。一般认为,如病人在病程中出现自身免疫反应,则可加强对肝细胞的损伤而发展成为慢性活动性肝炎。
5.乙型肝炎与原发性肝癌:近年来,关于乙型肝炎病毒感染与原发性肝癌的发生之间的关系,日益受到重视。国内外资料均提示肝炎患者的肝癌发病率比自然人群高。肝癌病人有HBV感染指示者也比自然人群高。Maupas等就HBV与原发性肝癌的密切关系作了以下论证:①乙型肝炎传染形成高度地方性的区域与原发性肝癌流行率高的地区,在地理上有相关性;②在地方性与非地方性区域,男性HBsAg慢性携带者中发生原发性肝癌的危险是相对恒定的。在此种人群中,原发性肝癌的年死亡率在250-500/10万人。粗略估计全世界HBsAg慢性携带者约1.75亿,原发性肝癌的年发生率为35万例。这就指出与HBV相关的原发性肝癌是在全世界人口中较为流行的癌症之一;③HBV感染可先于并经常伴随原发性肝癌的发生;④原发性肝癌常发生于与乙型肝炎病毒有关的慢性腩炎或肝硬化的肝;⑤在原发性肝癌患者取出的组织中存在HBV的特异性DNA及抗原;⑥有些原发性肝癌细胞系已能在培养中产生HBsAg ,并已证明HBV的DNA已能整合到这些细胞的基因组中。此外,含有HBV相似的生物化学、生物物理特性,它在其宿主可诱发肝硬化及原发性肝癌。在中国和美国的北京鸭(Anas domesticus)中已分离出一种相似的病毒。但对上述资料解释仍有不同观点:①HBV能引起致癌或促癌作用,须配合其它如遗传、内分泌、免疫与环境因素而导致肝癌;②肝癌是与HBV无关的因素引起,但这些癌细胞可能对HBV特别易感,以致持续携带病毒。
三、微生物学诊断
(一)乙肝抗原与抗体的检查法
目前已建立对HBsAg 、HBcAg及HBeAg及其抗体系统的检测法。以放射免疫法及酶联免疫法及酶联免疫法最为敏感,其次为反向被动血凝及免疫粘附血凝法。免疫扩散与对流电泳法虽不甚敏感,但仍为我国广泛采用。三种抗原体系统中以检测HBsAg最为常用。
(二)检测乙肝抗原抗体的实际意义
1.HBsAg:血清中检测到HBsAg ,表示体内感染了HBV,因而是一种特异性标志。HBsAg阳性见于:①急性乙型肝炎的潜伏期或急性期(大多短期阳性);②HBV致的慢性肝病、迁延性和慢性活动性肝炎、肝炎后肝硬化或原发性肝癌等。③无症状携带者。
2.抗HBs:表示曾感染过HBV,不论临床上有无肝炎症状表现,均已得到恢复,并且对HBV有一定的免疫力。
3.HBcAg与抗HBc:由于HBcAg主要存在于肝细胞核内,并仅存在于Dane颗粒中。因此,对病人血清不能检测HBcAg,而测抗HBc。血清内抗HBc阳性反映:①新近有过HBV感染;②体内有HBV增殖;③有助于诊断急性或慢性乙型肝炎,特别是少数病例就诊时已处于急性恢复期早期,HBsAg已从血中消失,此时血中仅有抗HBc存在,因此,对恢复期患者可作病因追索。
4.HBcAg和抗HBe:HBcAg的存在常表示病人血液有感染性。HBcAg阳性揭示病人肝脏可能有慢性损害,对预后判断有一定帮助。抗HBe阳性对病人可能有一定的保护力。
(三)检测乙肝抗原与抗体的实际用途
1.筛选供血员:通过检测HBsAg,筛选去除HBsAg 阳性的供血者,可使输血后乙肝发生率大幅度降低。
2.可作为乙肝病人或携带者的特异性诊断。
3.对乙肝病人预后和转归提供参考。一般认为急性乙肝患者,如HBsAg持续2个月以上者,约2/3病例可转为慢性肝炎。HBeAg阳性者病后发展成为慢性肝炎和肝硬化的可能性较大。
4.研究乙肝的流行病学,了解各地人群对乙肝的感染情况。
5.判断人群对乙肝的免疫水平,了解注射疫苗后抗体阳转与效价升高情况等。
四、防治原则
目前,乙型肝炎治疗上比较肯定的药物为α干扰素。国内外均有报道,经连续大剂量注射α干扰素半年后HBsAg转阴的例子。但最近发现,一些转阴后病人在停用干扰素后又转为阳性。其他如胸腺肽、转移因子治疗慢性肝炎虽有报道,但效果欠佳。
近来,对乙肝疫苗的研究及应用十分活跃。乙肝基因工程(酵母重组HBsAg)疫苗已大规模投入应用并取得可喜的结果。多肽疫苗、融合蛋白疫苗和基因疫苗的研制方兴未艾,相信经过多方努力,控制乙肝的愿望会成为现实。
