第二节 自由基的来源
一、概念
大多数化学键由双电子形成。这种键断裂时有二种可能:一种是异裂反应,成键的两个电子分给两种分裂产物之一,生成物为离子。另一种是均裂反应,两个电子均分给两个产物,此过程中产生的分裂物称为自由基(free-radical),在溶液中呈均一状态。自由基是指分子、原子或基团中有未配对电子的一类物质,如下述反应中的A·和B·,还有NO、NO[XB]2[/XB]、I·及Na·等均具有未配对电子。绝大多数自由基寿命短,生成后不稳定,易被周围环境吸收。在化学反应机理的研究中,发现自由基参与的反应占相当大比例。
二、自由基的来源
机体在代谢中不断地产生自由基,在酶催化的电子转移及氧化还原反应中,有许多自由基中间体参与;某些药物在体内以自由基中间体的活性形式发挥作用;在光化学反应及放射中多以自由基发挥作用。生物体的自由基可通过下面几种方式产生。
(一)放射线照射
放射性可直接或间接地对生物体发生作用,α-射线具有高能粒子作用,γ-射线具有电磁波作用,使生物体组织成分的分子激励或离子化;最终是化学键被切生成自由基,使机体被损害,这是放射线对生物直接作用的结果,这种方式是少量的。生物体内含有大量水,放射线首先使水分解,产生反应性非常高的自由基如H·和·OH等,H·和·OH可产生多种效应如破坏机体各组织细胞等,这是放射线对生物间接作用的结果。
生物体还被外部宇宙线、伦琴射线以及β射线包围,使生物体沐浴在大量射线之中,因而组织易遭损伤,加快老化的过程。
(二)机体周围自由基前身物的转变
我们周围环境有各种自由基或产生自由基的多种物质存在,如较稳定的氮氧化合物NO、NO[XB]2[/XB]自由基,在大气中还有汽车排出的碳化氢,空气烟雾中的氟利昂等经太阳紫外线照射及光分解产生多种碳的自由基及卤原子;大气中的臭氧也可能转变成过氧化物自由基。食物中某些成分如茶叶在空气中放置过久,自由基含量会升高,还有一些脂类含有自由基的前身物以及过氧化物、某些药物、激素和类固醇等经机体摄取后,在代谢过程中也容易产生自由基。
(三)生物体内活性氧的生成
机体在代谢中不断产生的自由基,种类繁多,其中以活性氧最多。
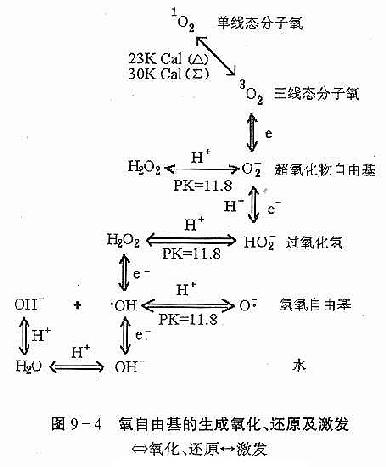
1.活性氧种类:氧是偶电分子,分子中存在一个σ键和两个三电子π键,其简化结构式为 。O[XB]2[/XB]可呈现两种状态,即单线态(singlet state)又称为激发态,以[SB]1[/SB]O[XB]2[/XB]表示;另一种为三线态(triplet state),又称为基态,以[SB]3[/SB]O[XB]2[/XB]表示,[SB]3[/SB]O[XB]2[/XB]可吸收能量变为激发态;
。O[XB]2[/XB]可呈现两种状态,即单线态(singlet state)又称为激发态,以[SB]1[/SB]O[XB]2[/XB]表示;另一种为三线态(triplet state),又称为基态,以[SB]3[/SB]O[XB]2[/XB]表示,[SB]3[/SB]O[XB]2[/XB]可吸收能量变为激发态;
[SB]3[/SB]O[XB]2[/XB]+hυ→[SB]1[/SB]O[XB]2[/XB]
氧化能力的指标是以氧分子的还原分子之间的标准氧化还原电位(E[XB]0[/XB][SB]1[/SB])而定,如图9-1所示。
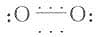
图9-2 氧分子及活性氧相互间的标准氧化还原电位(pH7.0)O:1.0Atm
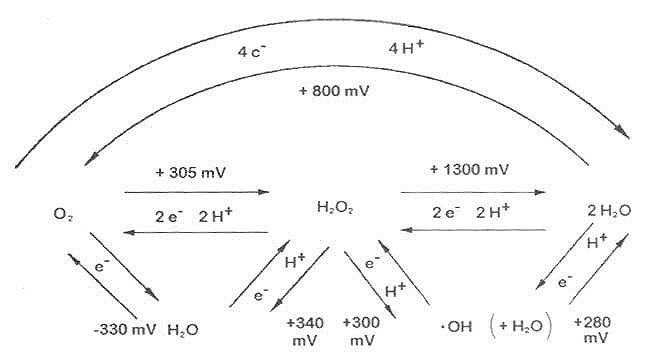
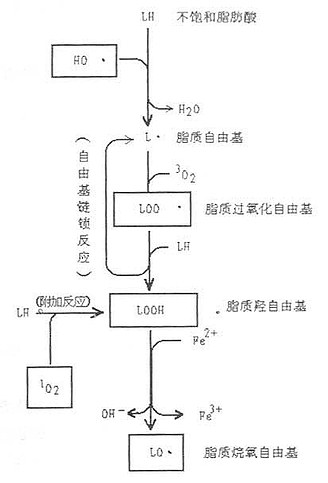
图9-3 脂质过氧化反应及其脂质自由基的生成(LOOH、LOO、LO·)
氧是一个重要的电子受体,因所得电子数不同,氧可产生多种还原产物:O[XB]2[/XB][SB]-[/SB]、·OH及H[XB]2[/XB]O[XB]2[/XB],他们的E[XB]0[/XB][SB]1[/SB]均比O[XB]2[/XB]高,具有强的氧化能力。
O[XB]2[/XB]+e→O[XB]2[/XB][SB]-[/SB]
O[XB]2[/XB]+2e+2H[SB]+[/SB]→H[XB]2[/XB]O[XB]2[/XB]
O[XB]2[/XB]+3e+3H[SB]+[/SB]→·OH+H[XB]2[/XB]O
O[XB]2[/XB]+4e+4H[SB]+[/SB]→2H[XB]2[/XB]O
不饱和脂肪酸在[SB]1[/SB]O[XB]2[/XB]等作用下,被氧化成过氧化脂(LOOH),LOOH又可进一步使脂肪酸氧化,脂质过氧化反应及其脂质自由基的生成如图9-3示。
以上所述的[SB]1[/SB]O[XB]2[/XB]、O[XB]2[/XB][SB]-[/SB]、H[XB]2[/XB]O[XB]2[/XB]、·OH及LOOH等统称为活性氧,但是体内不能产生活性的O[XB]2[/XB][SB]+[/SB]及原子氧。
基态氧本身毒性很低,但是O[XB]2[/XB][SB]-[/SB]、H[XB]2[/XB]O[XB]2[/XB]、·OH、[SB]1[/SB]O[XB]2[/XB]及LOOH毒性较大,这种活性氧的毒害作用称为氧的毒性。
2.活性氧的生成性质
(1)超氧化物自由基(O[XB]2[/XB][SB]-[/SB]):O[XB]2[/XB][SB]-[/SB]也可以HO[XB]2[/XB]形式存在,HO[XB]2[/XB]的pKa为8.4,在生理pH为7.45条件下,大部分以O[XB]2[/XB][SB]-[/SB]形成存在,即HO[XB]2[/XB]
H[SB]+[/SB]+O[XB]2[/XB][SB]-[/SB]。O[XB]2[/XB][SB]-[/SB]是O[XB]2[/XB]被一个电子还原生成,再由O[XB]2[/XB][SB]-[/SB]产生其它活性氧,O[XB]2[/XB][SB]-[/SB]是造成氧毒性的主要物质,在pH7.0时,O[XB]2[/XB][SB]-[/SB]/O[XB]2[/XB]和(2H[SB]+[/SB]、O[XB]2[/XB][SB]-[/SB])/H[XB]2[/XB]O[XB]2[/XB]的E[XB]0[/XB][SB]1[/SB]相应为-330毫伏和+940毫伏,O[XB]2[/XB][SB]-[/SB]既可起氧化作用,也可作为还原剂,当O[XB]2[/XB][SB]-[/SB]作为还原剂时,产物为H[XB]2[/XB]O[XB]2[/XB]。
O[XB]2[/XB][SB]-[/SB]的消除主要经超氧化物歧化酶(SOD)催化生成O[XB]2[/XB]和H[XB]2[/XB]O[XB]2[/XB]:
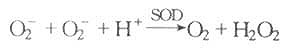
k=2.37×10[SB]9[/SB]M[SB]-1[/SB]S[SB]-1[/SB],O[XB]2[/XB][SB]-[/SB]也可自身进行歧化反应,反应速度相当慢:
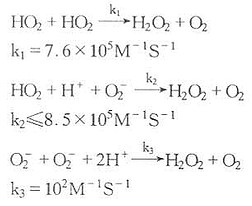
H[XB]2[/XB]O[XB]2[/XB]与O[XB]2[/XB][SB]-[/SB]反应可生成反应性更高的HO·及[SB]1[/SB]O[XB]2[/XB]:
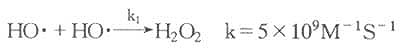
O[XB]2[/XB][SB]-[/SB]可被维生素C还原生成H[XB]2[/XB]O[XB]2[/XB],维生素C使O[XB]2[/XB][SB]-[/SB]还原的速度常数为2.7×10[SB]9[/SB]M[SB]-1[/SB]S[SB]-1[/SB],与SOD催化的反应速度常数相当,细胞内维生素C浓度高,因此维生素C有与SOD同等程度消除O[XB]2[/XB][SB]-[/SB]的作用。O[XB]2[/XB][SB]-[/SB]还可被维生素E及谷胱甘肽(GSH)还原生成H[XB]2[/XB]O[XB]2[/XB],GSH的-SH还原作用约相当于SOD的10%。
由于O[XB]2[/XB][SB]-[/SB]寿命短,检测有一定困难,只能用电子顺磁共振波谱(ERR)检出。
(2)过氧化氢(H[XB]2[/XB]O[XB]2[/XB]):H[XB]2[/XB]O[XB]2[/XB]可由O[XB]2[/XB][SB]-[/SB]的歧化反应生成,在D-氨基酸氧化酶、L-氨基酸氧化酶、葡萄糖氧化酶及亚硫酸盐氧化酶等作用下,把O[XB]2[/XB]作为电子受体,经两个电子还原生成H[XB]2[/XB]O[XB]2[/XB],在线粒体中也能直接生成H[XB]2[/XB]O[XB]2[/XB]。H[XB]2[/XB]O经放射线照射,一次生成·OH,再生成H[XB]2[/XB]O[XB]2[/XB]。
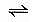
H[XB]2[/XB]O[XB]2[/XB]较稳定,反应性低,在体内浓度也比较低,(大鼠肝脏中为10[SB]-9[/SB]M),对机体几乎无毒性;H[XB]2[/XB]O[XB]2[/XB]可与铁离子生成反应性非常高的·OH:
H[XB]2[/XB]O[XB]2[/XB]+Fe[SB]2+[/SB]+H[SB]+[/SB]→OH+Fe[SB]3+[/SB]+H[XB]2[/XB]O
H[XB]2[/XB]O[XB]2[/XB]的消除依赖于两种酶,一是过氧化氢酶,催化H[XB]2[/XB]O[XB]2[/XB]歧化反应:2H[XB]2[/XB]O[XB]2[/XB]→2H[XB]2[/XB]O+O[XB]2[/XB];二是谷胱甘肽过氧化物酶。在GSH参与下使H[XB]2[/XB]O[XB]2[/XB]分解,GSH则变成氧化型谷胱甘肽。这两种酶可消除体内H[XB]2[/XB]O[XB]2[/XB]及过氧化物,防止血红蛋白及肝细胞膜部分被氧化破坏的可能。
(3)氢氧自由基(·OH):体内·OH从O[XB]2[/XB]直接生成的反应尚不清楚,机体可由O[XB]2[/XB][SB]-[/SB]生成系与H[XB]2[/XB]O[XB]2[/XB]生成系共同形成·OH自由基。水经放射线照射后的一级反应产物是·OH,由于·OH氧化能力很强,因此对机体毒性很大。
H[XB]2[/XB]O[XB]2[/XB]+Fe[SB]2+[/SB]+H[SB]+[/SB]→OH+Fe[SB]3+[/SB]+H[XB]2[/XB]O
H[XB]2[/XB]O[XB]2[/XB]+O[XB]2[/XB][SB]-[/SB]+H[SB]+[/SB]→·OH+H[XB]2[/XB]O+O[XB]2[/XB][SB]-[/SB]
·OH在水中寿命很短,一般不易以自旋共振(ESR)方法检出,有人利用DMPO(5,5-二甲基-1-吡咯啉-N-氧化物)作自旋捕获,成功地检出白细胞内产生的·OH,因DMPO与·OH形成一个较稳定的加成物DMPO-HO·。另外也可采用生物反应检出。
(4)单线态分子氧([SB]1[/SB]O[XB]2[/XB]):[SB]1[/SB]O[XB]2[/XB]是一个强的亲电子性的氧化剂,可用化学方法生成,也可由H[XB]2[/XB]O[XB]2[/XB]经氧化生成,即H[XB]2[/XB]O[XB]2[/XB]由次氯酸氧化生成[SB]1[/SB]O[XB]2[/XB]:
NaClO+H[XB]2[/XB]O[XB]2[/XB]→[SB]1[/SB]O[XB]2[/XB]+NaCl+H[XB]2[/XB]O[XB]2[/XB]
[SB]1[/SB]O[XB]2[/XB]可与芳香族碳氢化合物进行一系列的反应。
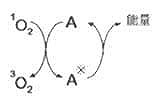
[SB]1[/SB]O[XB]2[/XB]可将能量转移给其他物质而变成[SB]3[/SB]O[XB]2[/XB],在此过程中,物质(A)作为[SB]1[/SB]O[XB]2[/XB]的淬灭剂,接受能量变为激发态(A[SB]*[/SB]),然后以热的形式放出能量回到基态A。水也可作为[SB]1[/SB]O[XB]2[/XB]的淬灭剂。
由于 [SB]1[/SB]O[XB]2[/XB]在水中寿命短,要检测出[SB]1[/SB]O[XB]2[/XB]有一定困难,最直接的证明是经[SB]1[/SB]O[XB]2[/XB]→[SB]3[/SB]O[XB]2[/XB]+hυ的化学发光观察,[SB]1[/SB]O[XB]2[/XB]单分子发光波长为1269微米及760微米。[SB]1[/SB]O[XB]2[/XB]的寿命在D[XB]2[/XB]O中比在水中长10倍,以此均可证明[SB]1[/SB]O[XB]2[/XB]的存在。最近有人利用光子计数器检测微粒体中产生的[SB]1[/SB]O[XB]2[/XB]已获得成功。
(5)过氧化脂类:人体内主要有亚油酸、亚麻酸及花生四烯酸,多以磷脂形式存在于质膜等生物膜中。这些不饱和脂肪酸可受[SB]1[/SB]O[XB]2[/XB]氧化,也可经·OH氧化生成过氧化脂质,生物膜上脂类既可在O[XB]2[/XB][SB]-[/SB]作用下生成过氧化脂质(LO·、LOO·、LOOH),也可经放射线照射生成脂类自由基(L·),这种在脂类中微量存在的L·,在氧参与下进行链锁反应,加速过氧化过程,如图9-3所示。过氧化脂质化学性质活泼,易进一步使脂类分解引起自由基反应,也可使GSH氧化,而本身变成较稳定的脂类羟基化合物(LOOH)。
氧自由基的生成、氧化还原及激发过程如图9-4所示。