第一节 基因突变致蛋白质合成异常
蛋白质性质是由DNA分子上碱基数量和顺序决定的。如果DNA分子的碱基数量或顺序发生变化,由它编码的蛋白质结构就发生相应的改变。由于基因突变导致蛋白质分子质和量异常,从而引起机体功能障碍的一类疾病称为分子病(molecular disease)。
分子病种类很多,根据各种蛋白质的功能可将分子病分为运输性蛋白病、凝血及抗凝血因子缺乏症、免疫蛋白缺陷病、膜蛋白病、受体蛋白病等.
一、血红蛋白病
血红蛋白病(hemoglobinopathy)是指由于珠蛋白分子结构或合成量异常所引起的疾病。它是人类孟德尔或遗传病中研究得最深入、最透彻的分子病,是运输性蛋白病的代表,是研究人类遗传机理的最好模型。据估计,全世界有一亿多人携带血红蛋白病的基因,我国南方发病率较高,因此,血红蛋白病是最常见的遗传之一。
(一)正常血红蛋白的组成,结构及遗传控制
1.人类血红蛋白的组成和发育变化 每个红细胞内含有约28000万个血红蛋白分子,每个分子由四个亚单位构成,每一个单位由一条珠蛋白肽链和一个血红素辅基组成,即血红蛋白分子是由二对珠蛋白链构成的球形四聚体(图4-10)。其中一对是类α链(α链和ξ链),由141个氨基酸组成;另一对是类β链(ε、β、γ和δ链),由146个氨基酸组成。由这6种不同的珠蛋白链组合成人类的6种不同的血红蛋白,即Hb Gower1(ξ2ε2)、HbGower2、(α2ε2)、HbPortland(ξ2γ2)、HbF(α2γ2)、HbA(α2β2)和HbA2(α2δ2)。其中γ链有两种亚型,即Gγ2和Aγ2,因此HbF有两类:α2Gγ2和α2Aγ2,前者的第136位氨酸为甘氨酸,后者为丙氨酸。
上述各种血蛋白在发育的不同阶段先后交替出现(图4-11)。在胚胎发育早期,合成胚胎血红蛋白HbGowerl、HbGower2和HbPortland。胎儿期(从8周至出生为止)主要是HbF。成人有3种血红蛋白:HbA,占95%以上;HbA2,占2%-3.5%;HbF,少于1.5%。
2.人类珠蛋白基因人类珠蛋白基因分为两类:一类是类α珠蛋白基因簇(α-likeglobin gene cluster),包括ξ和α基因;另一类是β珠蛋白基因簇(β-like globin gene cluster),包括ε、γ(Gγ和Aγ)、δ和β基因。
(1)类α珠蛋白基因:人类α珠蛋白基因簇位于16p13,每条染色体上均有两个α珠蛋白基因,因此,二倍体细胞中共有4个α基因,每个α基因几乎产生等量的α珠蛋白链。此外,在类α珠蛋白基因簇中,还包括两个ξ基因和一个假基因Ψα,这些基因紧密连锁其排列顺序如图4-12所示。
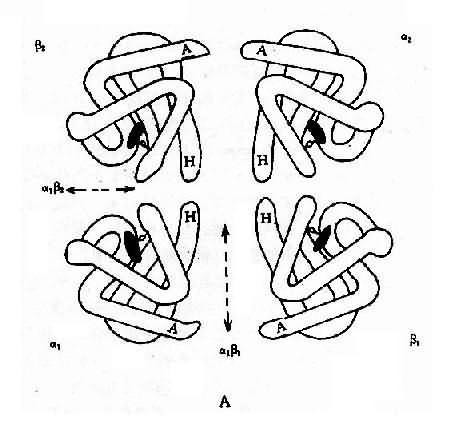
图4-10 血红蛋白结构示意图
A:血红蛋白四聚体(四级结构)
B:血红蛋白单体的三维空间结构
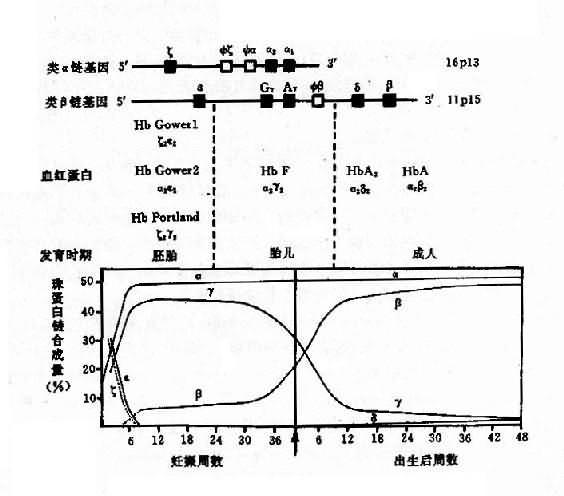
图4-11 人类血红蛋白类型及基发育过程中的演变
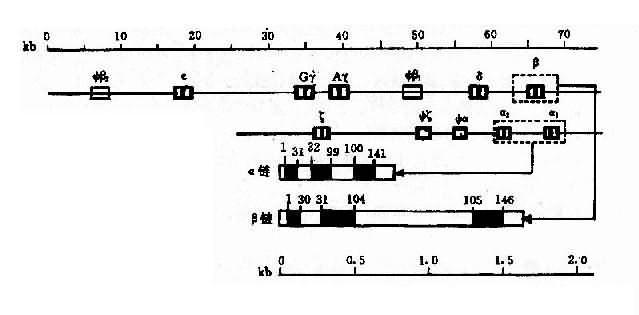
图4-12 人类α珠蛋白基因簇和人类β珠蛋白基因簇的结构及排列顺序
(2)类β珠蛋白基因:人类β珠蛋白基因簇分布于11p15,每条11号染色体上只有一个β珠蛋白基因,基因簇内各成员也都紧密连锁,其排列顺序如图4-12。类β珠蛋白基因簇的排列顺序与以育过程中的表达次序完全一致。
(3)珠蛋白基因的结构:类α与类β珠蛋白基因的结构相似,都含有3个外显子和2个内含子(IVS2和IVS2)。α珠蛋白基因中的IVS1和117bp组成,位于31和32密码子之间,IVS2由149或140bp组成,位于99和100密码子之间。类β基因中的IVS1含130bp,位于30和31密码之间,IVS2大约含850bp,位于104和105密码子之间。
(二)血红蛋白病的分类和分子基础
血红蛋白病可分为两大类,即异常血红蛋白病和地中海贫血。
1.异常血红蛋白病 异常血红蛋白(abnormalhemoglobin)是指由于珠蛋白基因突变导致珠蛋白肽链结构异常,如有临床表现者称为异常血红蛋白病或异常血红蛋白综合征。至今全世界已发现异常血红蛋白471种。国内已发现60种,其中20种是世界首报。尽管异常血红蛋白种类繁多,但仅约40%的异常血红蛋白对人体有不同程度的功能障碍。
(1)异常血红蛋白病的类型:
1)镰形细胞病(sickle cell disease):此病主要见于黑人。该病系由于β链第6位谷氨酸被缬氨酸取代,形成HbS,导致电荷改变,在脱氧情况下HbS聚合形成长棒状聚合物,使红细胞镰变,由于镰变引起血粘度增高,导致血管梗阻性继发症状,一过性剧痛(肌肉骨骼痛、腹痛),急性大面积组织损伤,心肌梗塞可致死,镰变细胞的变性降低还可引起溶血。HbS纯合子(HbSHbS)表现为镰形细胞性贫血,杂合子(HbAHbS)表现为镰形细胞性状,大部分无症状,但也可有轻度慢性贫血。
2)不稳定血红蛋白病(unstable hemoglobinpathies):已发现的不稳定血红蛋白在80种以上。由于Hb不稳定容易自发(或在氧化剂作用下)变性,形成变性珠蛋白小体(Heinz小体)。Heinz小体粘附红细胞膜上,导致了离子通透性增加;另外,由于变形性降低,当红细胞通过微循环时,红细胞被阻留破坏,导致血管内、外溶血。不稳定Hb病一般呈常染色体显性遗传(不完全显性),杂合子可有临床症状,纯合子可致死。临床表现与Hb不稳定程度、产生高铁血红蛋白的多少以及不稳定Hb的氧亲和力大小有关。轻者仅在服用磺胺等药物或有感染时溶血;重者需反复输血才能维持生命。
3)血红蛋白M病(HbM):HbM是因肽链中与血红素铁原子连接的组氨酸或邻近的氨基酸发生了替代,导致部分铁原子呈稳定的高铁状态,从而影响了正常的带氧功能,使组织供氧不足,导致临床上出现紫绀和继发性红细胞增多。本病呈常染色体显性遗传,杂合子HbM含量一般在30%以内,可引起紫绀症状。
4)氧亲和力改变的血红蛋白病:这类血红蛋白病是指由于肽链上氨基酸替代而使血红蛋白分子与氧的亲和力增高或降低,致运输氧功能改变。如引起Hb与氧亲和力增高,输送给组织的氧量减少,导致红细胞增多症;如引起Hb与氧亲和力降低,则使动脉血的氧饱和度下降,严重者可引起紫绀症状。
(2)异常血红蛋白的分子基础:异常血红蛋白的发生涉及基因突变的各种类型,概括举例如下。
1)单个碱基置换:大多数异常血红蛋白是由于珠蛋白基因发生单个碱基置换所致,其中多为错义突变。
①错义突变:例如镰形细胞贫血是β基因第6位密码子GAG变成GTG。中国人较常见的HbE是β基因第26位密码子由GAG(谷)→AAG(赖)所致。
②无义突变:例如HbMckees-Rock,其β链只有144个氨基酸组成,原因是β基因第145位酪氨酸密码子TAT改变为终止密码子TAA,使肽链合成提前终止。
③终止密码突变:例如Hb Constant Spring就是由于α珠蛋白基因第142位终止密码子TAA(mtRNA为UAA)突变为CAA(谷氨酰胺),结果α延长为172个氨基酸,这种突变基因转形成的mRNAI不稳定,所以导致α链合成减少,表现为α+地中海贫血。
2)移码突变:例如Hb Wagne是由于α链第138位丝氨酸密码子UCC丢失一个C,致使其3’端碱基顺序依次位移,重新编码,第142位终止信号变为可读密码,致使翻译至147位才终止(图4-13)。
3)整码突变:例如Hb Gum Hiu是β链缺失第91-95氨基酸(亮-组-半胱-门冬-赖),但其前后氨基酸顺序正常(图4-13)。

图4-13 人类α链和β链mRNAR不同突变类型
4)融合基因:例如Hb Lepore的类β链是由δ链和β链连接而成,肽链的N端像δ链,C端像β链,故称为δβ链,相反,Hb反Lepore(Hbanti-Lepore)其N端像β链,C端却像δ链,称为βδ链。这是由于染色体的错配联会和不等交换而形成的融合基因(fusion gene)(图4-14)。
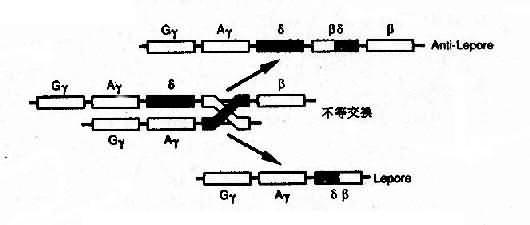
图4-14 血红蛋白融合基因形成机理
2.地中海贫血由于珠蛋白基因缺失或突变导致某种珠蛋的链合成障碍,造成α链和β链合成失去平衡面导致的溶血性贫血称为地中海贫血(thalassemia)。根据合成障碍的肽链不同可把地中海贫血分为α和β地中海贫血两类。此外还有少见的δβ和γβ地中海贫血。
(1)α地中海贫血(α-thalassemia,简称α地贫)是由于α珠蛋白基因的缺失或缺陷使α珠蛋白链(简称α链)的合成受到抑制而引起的溶血性贫血。如果一条16号染色体缺失1个α基因者称α+地贫(亦称α地2),缺失2个α基因者称为α0地贫(亦称α地1)。α地1的基因型可写作―/αα,α地2的单倍型则写成α-/αα.以上每种α地贫基因型与正常型配合可构成各种α地贫杂合子.各种α地贫基因型杂合子相互配合可构成各种纯合子或双重杂合子.α地中海贫血在我国多见于南方各省.
1)α地贫的临床类型:根据临床表现程度,依受累α基因数量不同而有差异,基本上可分为4类型.
①HbBart’s胎儿水肿综合征(HbBart’s hydrops fetalis syndrome):是两条16染色体的4个α基因全部缺失或缺陷,基因型为α0地贫纯合子(--/--),完全不能合成α链,不能形成胎儿HbF,相对过多的γ链形成γ四聚体(γ4)称为HbBart’s(γ4).HbBart’s对氧亲和力非常高,因而释放给组织的氧减少,造成组织严重缺氧导致胎儿水肿,引起死胎或新生儿死亡.患儿血红蛋白60%以上为HbBart’s,其余为 HbPortland.
患儿父母均为α0地贫杂合子,基因型为α/--.他们若再生育,则胎儿有1/4的机会为αHbBart’s水肿胎儿,1/4为正常人,1/2为α0地贫杂合子(α地1)
②血红蛋白H病:是α0地贫和α+地贫的双重杂合子,即有3个α基因缺失或缺陷,基因型为-α/--或α-/--,也可为ααT/--(αT代表有突变,如Hb Constant Spring)。因缺失3个α基因,只能合成少量α链,β链相对过多,形成β四聚体(β4),易被氧化,导致β4解体成游离的单链,游离β链沉淀聚积包涵体,附着于红细胞膜上,使红细胞膜受损,失去柔韧性,易被脾破坏,导致中等度或较严重的溶血性贫血,称为血红蛋白H病(Hbh disease) .
患者双亲的基因型多为α0地贫杂合子(αα/--)和α+地贫杂合子(α/αα),或为α0地贫杂合子(αα/--)和非缺失型地贫杂合子(ααT/αα)。婚配后其子女有1/4机会为正常人1/4为α+地贫杂合子,1/4为α0地贫杂合子及1/4为HbH病。如父母一方有αT,则导致非缺失型HbH病。
③轻型(标准型 )α地中海贫血:为α0地贫杂分子(--/αα)或α+地贫杂合子(α/α-),缺失两个α基因,间或有轻度贫血,我国主要是α0地贫杂合子。
轻型α地贫患者之间婚配,生育子女中可有1/4机会为HbBart水肿胎儿综合征。
④静止型α地中海贫血:仅缺失一个α基因,为α+地贫杂合子(-α/αα),无症状。
静止型α地贫与轻型地中海贫血个体婚配,可有1/4机会生育HbH病患儿。
2)α地中海贫血的分子基础:从基因缺陷程度来区分,可把α地贫分为缺失型和非缺失型(点突变)。
①基因缺失:可分为α+和α0地贫两种。α+地贫有两种基因型:左侧缺失(leftward deletion),缺失一个包括α2基因在内的DNA片段;②右侧缺失(right ward deletion), 缺失范围包括α2基因3’端和α1基因的5’端,结果形成了由α1的3’端和α2的5’端构成的融合基因。其发生机理是类α基因发生不等交换的结果。α0地贫基因缺失范围差别很大(图4-15)。

图4-15 类α基因簇缺失类型
②非缺失型(点突变:(类型见表4-1)。
(2)β地中海贫血:β地中海贫血(β梩halassemia,简称β地贫),是由于β珠蛋白基因的缺失或缺陷使β珠蛋白链(简称β链)的合成受到抑制而引起的溶血性贫血。完全不能合成β链者称β0地贫;能部分合成β链者(约为正常的5%-30%)称β+地贫。此外,还有δβ地贫。它们可以有不同的组合,即β0地贫纯合子(β0β0)、β0地贫双重杂合子(β0/β+)、β0地贫杂合子(β0βA)、β+地贫纯合子(β+/β+)和β+地贫杂合子(β+/βA)。β地贫在我国南方较常见。
1)临床分类:大致可有4种主要类型。
①重型β地中海贫血:患者是β+地贫、β0地贫或δβ0地贫的纯合子(其基因型分别为β+/β+、β0/β0和δβ0/δβ0)或是β+和β0地贫的双重杂合子(基因型为β0/β+)。这些患者的β链几乎不能合成,或合成量很少,以致无HbA或量很低,γ链的合成相对增加,使HbFt GbA2比率升高。由于HbF较HbA的氧亲和力高,在组织中不易释放出氧,所有β地贫患者有组织缺氧症状。组织缺氧促使红细胞生成素大量分泌,刺激骨髓的造血功能,使红骨髓大量增生,骨质受锓蚀致骨质疏松,可出现“地中海贫血面容”(头颅大,额顶及枕部隆起,鼻梁塌陷,上颌及牙齿前突,眼距宽,眼睑浮肿)。由于β链合成受抑制,过剩的游离α链形成α链包涵体,引起溶血性贫血,靠输血维持生命。
表4-1 点突变引起的地中海贫血
| 分子缺陷类型 |
| 1、生成无功能或稳定性降低的 ①无义突变 a116GAG---TAG,(G---T) ②移码突变 a130/31(--4bp) ③终止密码突变 142TAA---CAA(T---C) 形成Hb Constant Spring ④起始密码突变 a2ATG---ACG(T--C) 2、RNA加工突变 ①剪接改变 IVSI(GGTGAGGCT---GGCT) ②Poly(A)信号缺陷 AATAAAA ---AATAAG 3、产生不稳定H a2125CTG(亮)CCG(脯) 生成Hb Quong Sze |
②轻型β地中海贫血:患者是β+地贫、β0地贫或δβ0地贫的杂合子,基因型分别为β+/βA、β0/β+和δβ0/βA。这类患者由于还能合成相当量的β链,所以症状较轻,贫血不明显或轻度贫血。本病特点是HbA2升高(可达4%-8%)或(和)HbF升高。
③中间型β地中海贫血:患者通常是某些β地贫变异型的纯合子,如β+地贫(高F)/β+地贫(高F)或两种不同变异型地贫的双重杂合子,如β+,地贫/δβ+地贫。其症状介于重型和轻型之间,故称为中间型β地中海贫血。
④遗传胎儿血红蛋白持续增多症:患者是由于β基因簇中某些DNA片段的缺失或者点突变,使δ和β链合成受抑制,而γ链的合成明显增加,使成人红细胞内HbF含量持续增多,故称为遗传性胎儿血红蛋白持续增多症(hereditarypersistance of fetal hemoglobin,HPFH).HPFH的特点是HbF的成年人仍持续较高水平,无明显的临床症状。
2)β地中海贫血的分子基因:β地中海贫血迄今已发现100多种突变类型,其中10多种为缺失型,其余均为点突变。我国已报道17种点突变。
点突变:绝大多数β地中海贫血是由于β基因发生点突变所致,突变涉及基因内及旁侧表达顺序的各个环节。主要类型有4种。
a.编码区的无义突变、移码突变和起始密码突变:使生成的mRNA稳定性降低或形成无功能的mRNA,从而不能合成正常的β珠蛋白链,多数产生β0地贫,少数为β+地贫。例如无义突变密码子17(A→G)、43(G→T)都产生β0地贫;称码突变41/42(-TCTT),71/71(+A)和β0地贫;以及起始密码子突变ATG→AGG导致的β0都属这类。见于中国人。
b.非编码区IVS-1和IVS-2突变:影响前mRNA剪接等加工过程不能准确进行,形成异常的mRNA,导致β0或β+地贫。例如IVS-1的1位G→T为RNA拼接处改变;中国人中常见的IVS-2654,为内含子中由于碱基置换形成了一个新的裂解信号,影响正常位点的剪接,产生异常mRNA;还有一种是内含子中剪接位点的通用顺序上的同义突变,从而激活内含子或外显子中隐蔽裂解位点(cryptic splicihng site,CSS)如IVS-15(G→C)。CSS即DNA的一段顺序在点突变后可以形成剪切识别顺序(CCTATTGGT)的第7个碱基G如变为A,则产生新的切点,即CCTATTAG↓T)。
c.影响转录的突变:这类突变主要集中于起始位点上游的启动子TATA框,使转录效率降低,mRNA生成量减少而产生β+地贫。中国人的-29A→G,-28A→G都属于这类。
d.RNA裂解部位缺陷:这类突变是由于异常的RNA加帽部位和多聚腺苷酸化信号的突变,从而影响RNA转录而不能准确裂解,产生不稳定的mRNA,使正常β链生成量减少,导致β+地贫。例如在mRNA加帽部位发生A→C颠换,引起β+地贫(亚洲人。)又如,多聚腺苷酸化信号AATAAA→AACAAA,引起β+地贫。
e.编码区的外显子突变引起剪接作用的改变:这类突变是由于编码区的单碱基突变(错义突变或同义突变)激活邻近的隐蔽裂解信号,影响IVS正常位点的剪接,产生异常的mRNA。如东南亚常见HbE,是一种轻型的β地贫,其原因是当β链26位密码子发生G→A错义突变时,其相邻的裂解信号被激活,生成异常mRNA,产生HbE(图4-16)。
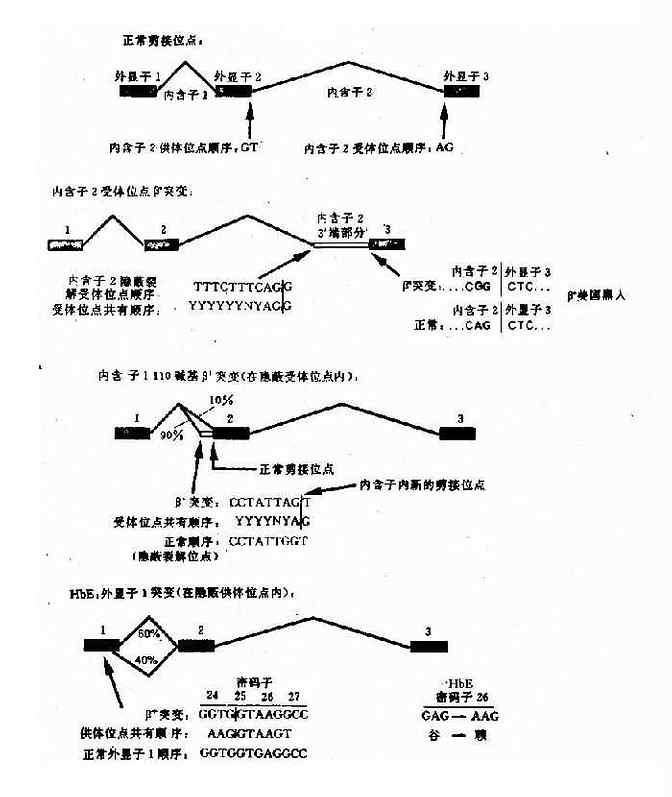
图4-16 干扰正常β珠蛋白剪接的突变举例
HbE:密码子26(G-→A)
谷→赖
GAG→AAG(QAJ)(错义突变)
β+(HbA 60%) βE(HbE 40%)
3)类β基因缺失:①按类β珠蛋白基因簇缺失长短大致可分为4种,即β0、δβ、γδ地中海贫血及遗传性胎儿血红蛋白持续增多症;②单纯由于β0基因缺失引起的β地中海贫血罕见;③融合基因,如HbLeproe,是类β基因缺失7kb导致δβ融合基因,形成β0地贫。
二、免疫缺陷病
免疫缺陷病(immunodeficiency)是指免疫系统功能障碍引起的一类疾病,就其原因可分为遗传性(原发性)与继发性两大类。根据参与免疫反应的细胞又可分为B细胞和T细胞以及联合免疫缺陷病。本节主要阐述具有免疫功能的各种蛋白质遗传性缺陷引起的免疫缺陷病。主要有下列几种:
1.无丙球蛋白血症 无丙球蛋白血症(agammaglobulinemia)分为两型:
(1)Bruton型:此型呈X连锁隐性遗传。血中B细胞缺如,导致血中IgA、IgG和IgM完全或基本缺如。而T细胞不受影响。患儿反复发生严重的细菌感染,但对病毒或真菌并无易感性,细胞免疫机制尚保存,对移植物有排斥反应。另有一型X连锁的低丙球蛋白血症(hypogammaglobulinemia)患者,除易发感染外,尚伴有生长激素缺乏所引起的生长发育迟缓,身材矮小,性发育延迟等症状(Fleischer 综合征)。
(2)瑞士型:瑞士型(Swiss type)呈常染色体隐性遗传。血中B细胞及T细胞均缺如,胸腺发育不全,对细菌、真菌及病毒抵抗力均低,对移植物无排斥能力。血中IgA、IgG和IgM均缺如或严重低下。预后较Bruton型更差,常于1岁内死亡。本型有异质性,也发现有X连锁型存在。
2.严重联合免疫缺陷病 严重联合免疫缺陷病(severecombined immunodeficiency)是指B细胞和T细胞均有缺陷的一类免疫缺陷病。一般分为4类,瑞士型无丙球蛋白血症属其中一类,其它3类为:X连锁淋巴细胞减少性低丙球蛋白血症、网状细胞发育不全和腺苷脱氨酶缺乏症。
3.选择性免疫球蛋白缺乏症 由于检测免疫球蛋白技术的改进,现在已有可能降低丙球蛋白血症按其主要缺乏的免疫球蛋白类型分为8类(表4-2)。
表4-2选择性免疫蛋白缺乏症分型
| IgA缺乏症 选择性IgA缺乏症 共济失调-毛细血管扩张症 Nezelof综合症 慢性皮肤粘膜念珠菌病 SIgA(分泌型)缺乏症 IgA缺乏症 IgA缺乏症 选择性IgM缺乏症 Wiskott-Aldrich综合征 IgE缺乏症 IgA-IgM缺乏症 IgA-IgG缺乏症 L链缺乏症 |
选择性IgA缺乏症为最常见类型。本病主要表现为上呼吸道感染、肺炎、支气管炎,其次为肠炎、自身免疫性疾病(类风湿关节炎、系统性红斑狼疮)等。
4.补体成分缺乏症 补体(cpmplement)是一个比较复杂的系统,包括12种成份,还有接近补体性质解裂素系统P因子(解裂素)、B因子和D因子,此外,还有几种调节蛋白B如Ci抑制因子(Ci INH)、C3b激活因子(3bINA)、βIH因子等。
基因突变可以导致补体合成障碍,引起补体缺乏症。已报告过的补体缺乏症至少有14种,包括:Ci INH,C1q,C1r,C2,C3,C3b灭活剂,C4,C5,C6,C7,C8,C9缺乏症及C5功能异常。这类疾病的主要表现是反复感染、皮下和粘膜水肿及自身免疫性疾患。
三、膜蛋白病
细胞膜是物质、能量、信息总的传递和变换的场所,具有广泛的生理功能,其中有许多功能是与膜蛋白息息相关的。按其功能可分为下列几类。
1.膜骨架蛋白病 以红细胞为例。红细胞膜是由双层脂质组成,外层主要为胆碱磷脂,内层主要为氨基磷脂,横跨双脂层及双脂层下有多种蛋白质*,横跨双脂层的蛋白质称为整合膜蛋白或跨膜蛋白(transmembrane proteins)(图4-17),其中有:①血型糖蛋白A、B、C(glycophorin,GP-A,B、C),有抗原和受体功能;②蛋白3为主要的阴离子转运蛋白,作为运输渠道。
* 膜蛋白的命名沿用电泳速率快慢依次为蛋白1-8,后来又分为亚带蛋白,如蛋白4有蛋白4.1、4.9等,当这些蛋白质的性质或功能明确后,有的名称又有改变,如蛋白2.1又称为锚蛋白等。
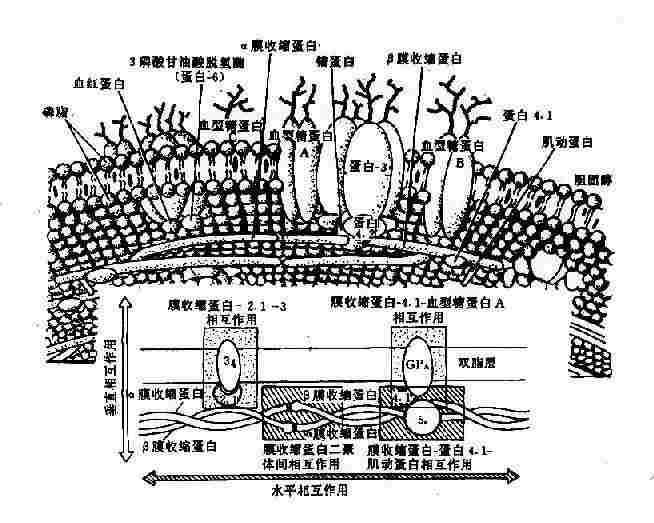
图4-17 红细胞膜的结构示意图
脂质内层与胞质接触部份的蛋白质称外周膜蛋白(peripheral membrane protein),其中有:①膜收缩蛋白(spectrin,Sp)是主要成分,由两种肽链组成,即α-Sp(240kd)与β-Sp(220kd)形成的二聚体(异常二聚体,heterodimer);②膜动蛋白(actin,蛋白5),呈短丝状,连接Sp的四聚体;③蛋白4.1其功能为促进Sp与膜动蛋白结合,并与GP-C连接,亦即将Sp固定在膜上;④蛋白4.2,它与阴离子通道、锚蛋白及蛋白4.1结合;⑤蛋白4.9,与Sp-Sp四聚体结合,再与Sp和蛋白4.1结合,构成红细胞膜骨架(membrane skeleton)的主体(图4-17);⑥锚蛋白(ankyrin,蛋白2.1),其作用似乎是连接β-Sp与蛋白3,使膜骨架蛋白固定在脂质内层,起“锚”的作用。其它尚有一些膜蛋白,其作用在探讨中。膜骨架的形成是维持红细胞双凹形结构、膜的可变形性和完整性的基础。基因突变导致这些膜蛋白结构和功能的改变,是一类遗传性溶血性贫血的根本原因。
(1)球形细胞增多平:球形细胞增多症(spherocytosis)是以球形红细胞增多为特点的溶血性疾病。患者呈慢性中度贫血、黄疸、脾大,大多数红细胞呈球形,脆性明显增高。本病多数呈常染色体显性遗传。从分子水平看,有遗传异质性,有Sp轻至中度缺乏、锚蛋白缺乏、蛋白4.2缺乏等病因。
(2)椭圆形细胞增多症:正常外周血中有1%-14%的椭圆形红细胞,而遗传性椭圆形红细胞增多症时,可增至50%-90%,出现溶血、贫血、黄疸、脾大等症状,红细胞脆性增高。多呈常染色体不完全显性遗传,其遗传基础也有异质性,可因Sp二聚体结合障碍、蛋白4.1异常或糖蛋白缺乏引起。
(3)热异形细胞增多症:热异形细胞增多症(pyropoikilocytosis,HPP)的特点是外周血红细胞对热不稳定,在加温至46℃时即出现异红细胞乃至红细胞碎片(正常要49℃才出现)。患者表现严重溶血。呈常染色体隐性遗传。Sp严重缺乏是本病的基本原因。
目前发现的几十种膜蛋白基因突变与上述疾病有关,但某种突变与这三种疾病间并没有发现必然的联系,但Sp突变仍占多数。
2.膜转运蛋白病 有些物质(如氨基酸、葡萄糖)通过细胞膜需要借助于分子导体(膜蛋白)进行易化扩散(faciliteddiffusion)。基因突变可导致膜蛋白质或量的改变,影响某些物质通过细胞膜的转运,由此产生的一类疾病称为转运病(transport disease)。例如胱氨酸尿症就是由于肾近曲小管和胃肠上皮细胞不能转运胱、赖、精和鸟氨酸4种氨基酸。其中特别是胱氨酸解度低,在尿中浓度超过30mg%时,即易产生胱氨酸结石。因此,尿路结石、感染、绞痛是本病的主要临床表现。目前已知的转运病有十多种。
3.肌膜蛋白病 肌膜蛋白病以附着于肌膜(sarcolemma)上的抗肌萎缩蛋白(dystrophin,又称肌营养不良蛋白)遗传缺陷为代表的假肥大型肌营养不良症(又称Duchenne型肌营养不良症,DMD)和表现较累的良性假肥大型肌营养不良症(又称Becker型肌营养不良症,BMD)加以讨论。
DMD是一种严重致残致死性X连锁隐性遗传病,发病率约为1/3500活男婴。其临床表现以肌肉的进行性萎缩和无力为特征。患者多在3-5岁发病,肌肉无力,走路困难呈鸭步,大部部分患者有腓肠肌假性肥大现象和不同程度的心肌损害,约30%伴有智力障碍。肌纤维萎缩变性,被脂肪及结缔组织替代。血清磷酸肌酸激酶等活性升高。多在12岁左右便不能行走,一般在20岁前死亡。BMD患者病情较轻,临床表现与DMD相似,在5-25岁发病,病程发展较缓慢,存活期较长,有活至63岁者。现在已证实DMD和BMD是同一基因发生不同突变的后果。
人群中DMD病例约2/3有家族史,呈X连锁隐性遗传,有约1/3病例为散发,是由基因新突变造成。DMD基因定位在Xp21,全长约2300kb,为迄今人类认识的最大基因。此基因至少含有79个外显子,内含子长度差异很大,可从1kb-180kb。cDNA全长13,974bp,编码3685个氨基酸,分子量为427kd。根据电脑提示该基因产物为一棒状结构的细胞骨架蛋白,可分为4个功能区(图4-18)。
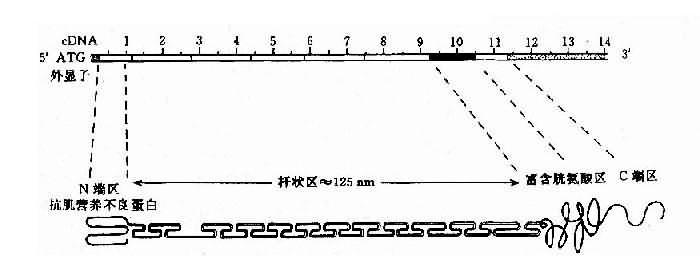
图4-18 DMD基因及其编码蛋白质的结构示意图
目前已知的DMD基因突变主要为缺失型,约占病例的50%-60%;重复(duplication)次之,约占6%,有两个缺失热区:即5’端的第4-21外显子(占缺失的20%);另一为第45-52外显子(占54%-60%)。内含子44约160-180kb,断裂频率最高,缺失导致移码突变者,多数会引起DMD,未导致移码者多为BMD。无论缺失或重复,都有可能使突变区域的两个残端形成连接片段,这对于家系分析、携带者检出及产前基因诊断都极有意义。
DMD基因上还存在一些短串联重复顺序(short tandem repeats,STR),已知有13个STR。DMD的STR多表现为两个核苷酸亚单元的串联重复,如CA串联(Ca repeats)。重复频数在不同个体差异很大,杂合子频率达25%-93%,为非缺失型DMD的产前诊断、携带者检出提供了一种有效的遗传标记。
目前尚无有效疗法,唯一有效的预防途径是对高风险胎儿进行产前诊断(参阅第十三章)。
四、凝血及抗凝血因子缺乏症
凝血是一复杂的生理过程,包括多种凝血因子及抗凝血因子参与。遗传性凝血障碍包括低凝和高凝两种情况。前者是由于基因突变致凝血因子活性降低,后者是由于抗凝血因子活性缺乏。
1.凝血因子缺乏症
除Ca2+与凝血活素外,所有凝血因子都有遗传性缺乏的报告,其中血友病,特别是甲型血友病较为多见。现主要就血友病及与其有关的血管性假血友病加以介绍。
血友病(hemophilia)除甲、乙、丙三型外,加上后来又发现的一种vWF因子(vonwillibrand factor)缺乏的血管性假血友病,构成血友病的四种类型。1986-1989年全国24省、市,37个地区作血友病患病率的调查,调查人数16866 654人,总患病率2.73/10万(男性5.21/10万,女性0.06/10万),与欧美相比较低,四型的构成比是:甲型79.8%,乙型14.1%,丙型2.8%,血管性假血友病3.3%。
(1)甲型血友病:甲型血友病(hemophilia A)又名抗血友病球蛋白(antihemophilicglobulin,AHG)缺乏症或第Ⅷ因子缺乏症。主要表现为出血倾向,其出血特点为:①缓慢持续渗血;②多发生于轻微创伤之后;③出血部位广泛,常反复发生,可形成血肿,并节变形,死因多为颅内出血。
现知,Ⅷ因子由三种成分组成:①FⅧ:C(AHG);②FⅧ:Ag(Ⅷ因子相关抗原);③vWF因子。甲型血友病为AHG遗传性缺乏所致。
本病为X连锁隐性遗传,基因定位于Xq28,基因跨度超过186kb,由26个外显子(占9kb)及25个内含子(占177kb)组成,编码2351个氨基酸,已发现缺失型(包括错义、无义及移码突变等)共46种以上。杂合子的鉴定对开展遗传咨询很重要。过去多通过测定血浆AHG水平或用ⅧR:Ag/AHG比值来检出杂合子,现已能采取分子遗传学手段,特别是已成功地应用DNA印迹杂交、PCR技术等于产前诊断,这对防止重型患儿出生,十分有效。
治疗可使用各种AHG制剂,但需长期使用,正在研究的基因治疗将会是本病的根治方法。
(2)乙型血友病:乙型血友病(hemophilia B)又名血浆凝血活酶成分(PTC)缺乏症或第Ⅸ因子缺乏症。此型临床表现酷似甲型,但发病率较低,遗传方式亦为Ⅹ连锁隐性遗传,由于杂合子Ⅸ因子活性仅为正常1/3,某些杂合子可出现症状,故女性病人较甲型多见。
人类第Ⅸ因子基因已定位Xq27.1,基因总长度为34kb左右,由8个外显子组成。已鉴定出的突变有100种之多(部分缺失及全缺失者30种,其余为各种类型点突变)。我国王宁波等报告了重庆发现的5种点突变(外显子2和5)。上海曾溢滔等发现1例1-3内含子5kb片段缺失。在这些突变中发现几例启动子突变,临床表现为儿童期有严重出血倾向,但到青春期后自发出血减轻。后证明,雄性类固醇可诱导启动子产生Ⅸ因子,这也表明临床症状轻重与突变性质可以有一定关系。
本型亦多采用输血浆或浓缩血浆制剂治疗,将第Ⅸ因子活性提高到25%以上即有疗效。产前诊断是防止本病患儿出生的有效方法。近年,我国薜京伦等在Ⅸ因子缺乏症的基因治疗方面取得了进展,有望在临床取得长期稳定疗效。
(3)丙型血友病:丙型血友病(hemophilia C)又名血浆凝血活酶前质(PTA)缺乏症(plasma thromboplastic antecedent deficiency)或第Ⅸ因子缺乏症。此型症状较甲、乙型轻。本病种族倾向明显,多见于土耳其南部犹太人后裔。遗传方式属染色体隐性遗传。现知,基因定位于15q11,基因长度为23kb,由15个外显子组成,编码625个氨基酸,但仅第11-15外显子编码羧基端具有凝血功能为Ⅺ因子主要成分。已发现3种点突变。本病纯合子的Ⅺ因子活性在20%以下,杂合子为30%-65%。多数严重缺乏者用小剂量正常或浓缩血浆治疗即显效。
(4)血管性假血友病:血管性假血友病(von Willebrand disease)是一种较多见的与第Ⅷ因子有关的遗传性凝血障碍。与本病有关的von Willebrand因子(v WF)是一大分子量的糖蛋白。基因定位于12pter-p12,vWF基因长度为180kb,有52个外显子,mRNA总长度为9kb左右编码2813个氨基酸。vWF蛋白由血管内皮细胞及巨噬细胞分泌,它在血中不仅作为Ⅷ因子载体,而且可增强Ⅷ稳定性,故vWF因子缺乏往往伴有Ⅷ因子活性降低。此外,血小板α颗粒中含vWF,故也参与血小板聚集,在凝血中发挥作用。本病患者有明显的出血倾向。血中AGH活性降低,但不如甲型血友病严重,从基因水平已发现20多种突变型。
由于对本病基因有足够的了解,已可通过RFLP连锁分析或PCR法对本病进行产前诊断。
此外,由于遗传性血小板缺乏或功能障碍和纤维蛋白原的遗传性缺陷都可造成低凝状态,在此不多赘述。
2.抗凝血因子缺乏症
(1)遗传性抗凝血酶Ⅲ缺乏症:抗凝血酶Ⅲ(antithrombinⅢ,ATⅢ)对凝血酶Xa有抑制作用,肝素能加速其对凝血酶的抑制。其次,ATⅢ还有抑制Ⅸ、Ⅺ及Ⅻ的功能。
遗传性抗凝血酶Ⅲ缺乏症(hereditary antithrombin Ⅲ deficiency)的临床表现为容易发生血栓形成(主要部位为髂静脉)及肺体塞。
本病为常染色体显性遗传。发病率在不同种族有显著差异。欧美白种人中可高1:2000-5000。我国也已有个例报告。现知,ATⅢ基因定位1q23,基因长16kb,由7个外显子组成,编码432个氨基酸,至少已发现20种以上的突变类型,表现出不同的功能缺陷。
(2)遗传性蛋白C系统异常:遗传性蛋白C系统由蛋白C(PC)、蛋白S(PS)、血栓调节蛋白(thrombomdorlin,TM)及活性蛋白C抑制物(APC1)组成,它们之间的关系见图4-19。活化的蛋白C有抑制Va、Ⅻa及促进纤维蛋白溶解的作用。蛋白C系统缺乏症有3种:
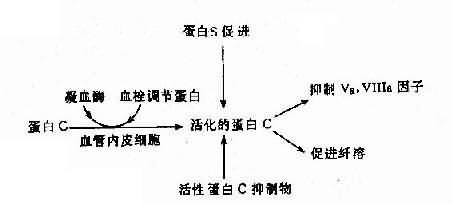
图4-19 蛋白C、蛋白S及活性蛋白C抑制物的相互关系
1)蛋白C缺乏症:主要症状是静脉血栓形成,常见于深部静脉。本病发生率估计为1:16000,呈常染色体显性(或不完全显性)遗传,纯合子严重,表现为出血性皮肤坏死、弥漫性血管内凝血(DIC)和血栓。杂合子多数在青壮年发病。蛋白C基因定位2号染色体,基因长12kb,由8个外显子组成,已鉴定出若干种缺失型及点突变病例,也有涉及mRAN加工缺陷者。
2)蛋白S缺乏症:蛋白S的作用是促进活化蛋白C(APC)结合于磷脂,加速APC灭活Va因子。本病亦属常染色体显性(或不完全显性)遗传。基因定位在3号染色体,其总长度为45kb。上海也已报告2例PS缺乏症。
3)先天性活化蛋白C抑制缺乏症(congenitaldeficiency of activated protein Cinhibitor)。
其它还有遗传性纤溶系统异常,包括①先天性异常纤溶酶原血症;②先天性纤溶酶原激活物释放异常;③遗传性纤溶酶原激活抑制物增多症;④血块异常所致先天性纤溶减弱等,均表现出高凝状态的各种症状。
五、受体蛋白病
受体是存在于细胞膜上、胞质中或核内的一类具有特殊功能的蛋白质。现已证明具有调节生理功能和特异性受体达30种以上。其中包括多肽激素受体、固醇类激素受体以及神经递质、前列腺素、免疫性因子、脂蛋白等受体。由于受体的本制是蛋白质,不言而喻,基因突变也可导致受体蛋白质和量的改变。由于受体蛋白遗传性缺陷引起的一类疾病,称为受体病(receptor diseae)。
受体病有获得性与遗传性之分。遗传性受体病研究得较多的有下列4种:
1.家族性高胆固醇血症 家族性高胆固醇血症(familialhypercholesterolemia,FH)的临床表现是:出生时即存在高胆固醇血症,增高的胆固醇主要为低密度脂蛋白胆固醇()LDL-C)和β极低密度脂蛋白(β-LDLC),黄色瘤(xanthoma)即增高的胆固醇在组织广泛沉积。其最严重的后果是早年发生动脉粥样硬化。纯合子在5-30岁即表现心绞痛和心肌梗塞症状,可骤死。杂合子发生冠心病稍迟且发生率较低。
本病为常染色体显性遗传病。在人群中,杂合子发生率为1:500,杂合子临床表现较轻,故属不完全显性遗传,外显率高(90%-100%)。
本病的主要病因是LDL受体(LDLR)的遗传性缺乏。血浆中的LDL和β-VLDL与LDL受体结合后,内吞入细胞,在溶酶体中LDL与LDLR分离,LDLR回到细胞表面重新利用,LDL则在胆固醇酯酶作用下,释出胆固醇供细胞利用。在这一过程中,细胞表面有功能的LDLR数量决定了血浆中LDL及β-VLDL的浓度。现知LDLR的编码基因位于19p1.3-p13.3,总长度45kb,由18个外显子组成。已发现FH患者有数十种突变,包括缺失型突变(主要的)、错义突变、无义突变、移码突变及整码突变。表现为LDLR功能异常有4种类型:①细胞膜上完全无LDLR;②LDLR明显减少;③LDLR无功能不能与LDL结合;④LDLR与LDL结合后不能内吞,可能是由于合成受体前后有加工缺陷。
2.睾丸女性化综合征 睾丸女性化综合征(testicularferminization syndrome)又称雄性素全不敏感综合征(complete androgeninsensitivity syndrome,CAIS),为最常见男性假两性畸形。患者核型为46,XY,有睾丸,能分泌雄性素,但缺乏雄性素受体,雄性素不能发生效应(图4-20)。
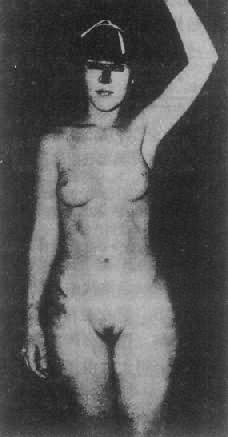
图4-20睾丸女性化综合征患者(核型46,XY)
