溶血性贫血(Hemolytic Anemia)
溶血性贫血系指红细胞破坏加速,而骨髓造血功能代偿不足时发生的一类贫血。如要骨髓能够增加红细胞生成,足以代偿红细胞的生存期缩短,则不会发生贫血,这种状态称为代偿性溶血性疾病(Compensated hemolytic disease)。
【分类】
根据红细胞寿命缩短的原因,可分为红细胞内在缺陷和外来因素所致的溶血性贫血。
一、红细胞内在缺陷所致的溶血性贫血
除少数外,内在缺陷是遗传性的。用Asby/技术,正常的红细胞输给病人,红细胞生存期正常,而病人的红细胞输给正常人,其红细胞生存期缩短。内在缺陷,溶血部位常在血管外。
(一)红细胞膜的缺陷 红细胞膜结构的缺陷可造成膜的可渗透性、硬度异常,或不稳定和容易破碎。在大多数病例中,缺陷在于一种或一种以上骨架蛋白,红细胞形态也异常。这些遗传性膜的疾病,包括遗传性球形细胞增多症,遗传性椭圆形细胞增多症。阵发性睡眠性血红蛋白尿,其红细胞膜对补体异常敏感,但其膜的缺陷是一种获得性的异常。
(二)血红蛋白结构或生成缺陷 血红蛋白结构异常,使血红蛋白成为不溶性或不稳定,导致红细胞僵硬,最后溶血。如镰形细胞性贫血或不稳定血红蛋白病。地中海贫血时,过多的珠蛋白链沉淀,使红细胞变硬,破坏而发生溶血性贫血。
(三)红细胞酶的缺陷 为维持血红蛋白和膜的巯基(硫氢基)处于还原状态或维持足够水平的ATP以进行阳离子交换的红细胞酶的缺乏,可导致溶血性贫血,酶的疾病可分为2类:①红细胞无氧糖酵解中酶的缺乏(如丙酮酸激酶),②红细胞磷酸已糖旁路中酶的缺乏(如葡萄糖6磷酸脱氢酶)。
二、红细胞外在缺陷所致的溶血性贫血
外部的缺陷,通常是获得性的,红细胞可受到化学的、机械的或物理因素、生物及免疫学因素的损伤而发生溶血。溶血可在血管内,也可在血管外。
引起溶血性贫血的各种主要原因见表5-2-8
表5-2-8 溶血性贫血的病因学分类
| 一、红细胞内在缺陷 |
| (一)遗传性 1、细胞膜异常:遗传性球形细胞增多症,遗传性椭圆形细胞增多症等 2、红细胞酶异常: (1)红细胞糖无氧酵解中酶的缺乏:丙酮酸激酶缺乏等 (2)红细胞磷酸已糖旁路中酶缺乏:葡萄糖-6-磷酸脱氢酶(G6PD)缺乏等 3、血红蛋白中珠蛋白链异常: (1)肽链结构异常(血红蛋白病):镰形细胞性贫血、血红蛋白C、D、E等的纯合子状态、不稳定血红蛋白等 (2)肽链量的异常:海洋性贫血(地中海贫血) |
| (二)获得性 阵发性睡眠性血红蛋白尿 |
| 二、红细胞外在因素 |
| (一)免疫性 · 自体免疫 (1)温抗体型;(2)冷抗体型 2.新生儿同种免疫;3、血型不合输血;4、药物性 |
| (二)机械性 1.心脏创伤性;2、微血管病性;3、行军性血红蛋白尿 |
| (三)化学、物理、生物因素 · 化学毒物及药物:苯、苯肼、铅、氢氧化砷、磺胺类等 · 大面积烧伤 · 感染:疟疾、产气荚膜杆菌、溶血性链球菌等 · 生物毒素:溶血性蛇毒、毒蕈中毒等。 |
| (四)脾机能亢进 |
【发病机理】
红细胞过早地被破坏可以发生在血管外或血管内。血管外溶血(extravascularhemolysis)即红细胞被脾、肝中的巨噬细胞(单核一巨噬细胞系统)吞噬后破坏。血管内溶血(intravascularhemolysis)是红细胞直接在血循环中破裂,红细胞的内容(血红蛋白)直接被释放入血浆。
一、血管外溶血
红细胞在巨噬细胞中破坏后,血红蛋白被释放出来,就在巨噬细胞内分解成珠蛋白(globin)和血红素(hematin),血红素分解为铁,一氧化碳,碳氧血红蛋白(Carboxyhemoglobin),胆绿素(biliverdin),后者最后变成胆红素(bilirubin)被血浆运至肝脏。在肝内,胆红素与葡萄糖醛酸结合为直接胆红素。未与葡萄糖醛酸结合的胆红素称间接胆红素。胆红素与葡萄糖结合为直接胆红素。未与葡萄糖醛酸结合的胆红素称间接胆红素。胆红素葡萄糖醛酸复合物经胆汁排入小肠,分解为粪尿胆原。粪尿胆原可被吸收入血液而从尿内排出。血管外溶血可发生于脾、肝或骨髓的巨噬细胞。脾脏能最有效地清除有轻微损伤的红细胞,因在脾索中有独特的循环结构。肝脏血流量超过脾脏血流量,它是除去和吞噬广泛损伤红细胞的重要部位。IgM和补体二者致敏的红细胞,很容易在肝脏被有C3b受体的肝巨噬细胞除去。反之,IgM致敏而没有补体成分附着的红细胞,其生存期正常,因为巨噬细胞没有IgG致敏的红细胞,可激活或不激活补体,因红细胞表面IgG的许多分子只与一个补体分子结合。而IgG致敏的红细胞,即使没有补体也能被巨噬细胞清除。IgG致敏的红细胞主要在脾脏被巨噬细胞(有IgG-Fe受体,还有C3b受体)清除。IgG和补体二者同时致敏的红细胞的清除较迅速,因为吞噬作用受二种受体介导。所以血管外溶血的部位和程度决定于抗体的种类和有无补体存在。骨髓巨噬细胞清除有内在异常的成熟的前体细胞,导致无效红细胞生成,如地中海贫血和巨幼细胞性贫血。遗传性红细胞膜、血红蛋白和细胞内酶缺陷等伴发的溶血性贫血,都有一定程度的无效红细胞生成。
二、血管内溶血
发生血管内溶血时,血红蛋白直接被释放入血浆,与血浆中的结合珠蛋白(haptoglobin)―一种α2糖蛋白一结合,由于其分子较大,故不被肾脏排泄而被肝细胞摄取,最后变成胆红素。溶血较多时血浆中结合珠蛋白的浓度显著降低或消失,不过血浆中结合珠蛋白浓度的高低也受到其他多种因素的影响。
当血浆内结合珠蛋白全部与血红蛋白结合后,从游离血红蛋白分解出的血红素能与血结素(hemopexin)-一种β糖蛋白-结合,然后也被肝细胞摄取。大量溶血时血浆血结素的浓度亦降低。
血浆中的游离血红蛋白被氧化成高铁血红蛋白(methemoglobin),再分解为高铁血红素(methematin),然后与血浆中白蛋白结合成高铁血红白蛋白(methemalbumin),最后与血结素结合而被细胞摄取。血浆如有较多游离的血红蛋白,血浆可呈粉红色,但由于高铁血红白蛋白呈棕色,高铁血红蛋白呈褐色,因此其粉红色被掩盖而不易看出。
当血浆中的蛋白质与血红蛋白的结合已达饱和时,未结合的血红蛋白由于分子较小(分子量66000)出现于尿内,使尿色变红。高铁血红蛋白亦可出现于尿内,使尿呈褐色,高铁血红白蛋白由于分子大、不出现于尿内。
尿中血红蛋白被肾小管上皮吸收后分解的铁以铁蛋白及含铁血黄素的形式贮积于肾小管上皮细胞内,随上皮细胞脱落而自尿排出,以尿沉渣作亚铁氰化钾染色,可见到上皮细胞内有蓝色的含铁血黄素颗粒,含铁血黄素尿常出现于慢性血管内溶血,如阵发性睡眠性血红蛋白尿及机械性溶血性贫血。
红细胞破坏后血红蛋白发生的一系列代谢改变见图5-2-5。
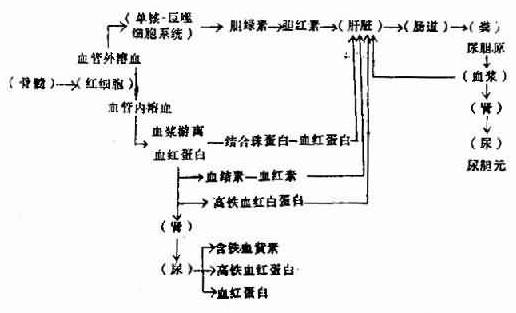
图5-2-5 溶血后血红蛋白代谢的途径
【临床表现】
根据红细胞破坏的部位不同分为血管内溶血和血管外溶血两种类型。血管内溶血一般呈急性溶血,也可表现为慢性溶血过程,多见于阵发性睡眠性血红蛋白尿,G-6PD缺乏,冷抗体型自体免疫性溶血性贫血,以及药物、理化、感染等因素所致之溶血性贫血。血管外溶血一般呈慢性溶血过程,多见于遗传性球形红细胞增多症、血红蛋白病、温抗体型自体免疫性溶血性贫血。
溶血性贫血的临床表现与溶血的缓急、程度和场所有关。
一、急性溶血
起病急骤、可突发寒战、高热、面色苍白、腰酸背痛、气促、乏力、烦燥、亦可出现恶心、呕吐、腹痛等胃肠道症状。这是由于红细胞大量破坏,其分解产物对机体的毒性作用所致。游离血红蛋白在血浆内浓度越过130mg%时,即由尿液排出,出现血红蛋白尿,尿色如浓红茶或酱油样,12小时后可出现黄疸,溶血产物损害肾小管细胞,引起坏死和血红蛋白沉积于肾小管,以及周围循环衰弱等因素,可致急性肾功能衰竭。由于贫血,缺氧、严重者可发生神志淡漠或昏迷,休克和心功能不全。
二、慢性溶血
起病较缓慢。除乏力、苍白、气促、头晕等一般性贫血常见的症状、体征外,可有不同程度的黄疸,脾、肝肿大多见,胆结石为较多见的并发症,可发生阻塞性黄疸。下肢踝部皮肤产生溃疡,不易愈合,常见于镰形细胞性贫血患者。
【诊断】
溶血性贫血的诊断可分成两步:①首先明确有无溶血,应寻找红细胞破坏增加的证据;②查明溶血的原因,则须经过病史、症状、体征以及实验室等资料的综合分析来作判断。
一、病史
除询问发病缓急,主要症状以及病情进程外还应着重询问以下各项:
(一)地区性 强调家庭籍贯,如地中海贫血多见于广东、广西及浙江等沿海地区。
(二)家族史 近亲中如有贫血、黄疸、脾肿大者,则有先天性溶血性贫血可能。
(三)药物接触史 药物可诱发免疫性溶血性贫血,氧化性药物可使不稳定血红蛋白病及G6PD缺乏症发生溶血。
(四)引起溶血性贫血的原发病史 如淋巴瘤可伴有免疫性溶血性贫血。
(五)诱发因素 如过劳、寒冷刺激及服蚕豆等。
二、体征
应注意贫血、黄疽、肝脾肿大等。
三、实验室检查
检查目的和步骤有:
(一)确定是否为溶血性贫血 可根据红细胞破坏增加和骨髓代偿功能增强而确定。
1.红细胞破坏增加的证据
(1)红细胞计数下降,一般呈正细胞正色素性贫血。
(2)血清间接胆红素增多。血清胆红素浓度不仅决定于溶血的程度,还决定于肝脏清除间接胆红素的能力,故黄疸为轻度或中度,血清胆红素一般在17.1-51.3ukmol/L(1-3mg/dl)左右,很少超过136.8umol/L(8mg/dl),当黄疸不显时,并不能排除溶血性贫血。
(3)尿内尿胆原的排泄量增多。尿内尿胆原和尿胆素常增加。在肝功能减退时,肝脏无能重复处理从肠内吸收来的尿胆原,尿中尿胆原也会增加,故对溶血性贫血的诊断,价值不是很大。粪内尿胆原是增加的,但粪内尿胆原的定量测定现在已不在用作诊断方法之一。尿内胆红素阴性,除非同时有阻塞性黄疸。
(4)血浆结合珠蛋白明显减少或消失。结合珠蛋白是在肝脏产生能与血红蛋白结合的清糖蛋白,正常值为0.7-1.5g/L(70-150mg/dl)。血管内和血管外溶血结合珠蛋白含量均降低。在感染、炎症、恶性肿瘤或皮质类固醇治疗时可以增多。因此,在解释结果时须考虑其他因素的影响。
(5)血浆游离血红蛋白浓度增高。正常血浆内有少量游离血红蛋白,一般正常不超过50mg/L(5mg/dl),当大量血管内溶血时,血浆游离血红蛋白浓度增高可达2.0g/L(200mg/dl)。血浆中有高铁血红白蛋白存在时,血浆变成金黄色或棕色,可用分光光度计或血清电泳证明其存在。在血管内溶血后,它在血液中存在的时间为几小时至几天。
(6)尿内出现血红蛋白(急性溶血)或含铁血黄素(慢性溶血)。
(7)红细胞生存时间缩短,红细胞的生存时间因溶血的轻重不同可有不同程度的缩短,可用放射性铬(51Cr)加以测定,正常红细胞的T1/2(51Cr)为25-32天,此值低于正常表示红细胞的生存时间缩短,也表示溶血增多。由于放射性核素检验的技术操作不够简单方便,观察时间又长,故临床工作中应用较少,大多用于科研工作。
2.骨髓代偿性增生的证据。
(1)网织红细胞增多。这是溶血性贫血重要证据之一。网织红细胞增多至5-20%,急性溶血者可高达50-70%以上,但在发生再障危象时,网织红细胞数可减低或消失。
(2)末梢血中出现有核红细胞,其数量一般不多。并可见到嗜多色性和嗜碱性点彩红细胞,红细胞大小不匀和异形较明显。可见到球形、靶形、镰形、盔形或破碎红细胞。血小板和白细胞计数大多正常或增多,但在某些溶血性贫血时也可以减少。急性大量溶血可引起类白血病反应。
(3)骨髓内幼红细胞增生明显增多,粒红比例下降或倒置。少数病例如有叶酸缺乏,可出现类巨幼细胞,经用叶酸治疗后即消失,个别病例如正值“再生障碍危象时”,红系细胞显著减少。
(二)确定属于哪一种溶血性贫血,可根据需要选作下列特殊试验。
1、红细胞形态观察 成熟红细胞形态改变可为溶血性贫血诊断提供重要的线索。如球形红细胞增多,见于遗传性球形红细胞增多症及免疫性溶血性贫血;靶形细胞提示地中海贫血、血红蛋白E病、血红蛋白C病等;盔形细胞、破碎细胞,表示机械性溶血性贫血;镰形细胞,表示镰形细胞性贫血,数量往往不多。
2、红细胞脆性试验 是反映红细胞表面面积与容积比例关系的一种检验方法。如红细胞表面面积/容积比例缩小。则脆性增加,比例增大则脆性减低,脆性增高见于遗传性球形细胞增多症,红细胞脆性减低见于靶形红细胞症。
3、抗人球蛋白试验(Coombs试验) 测定体内有无不完全的抗体。直接抗人球蛋白试验是测定患者红细胞上有无附着不完全抗体,间接抗人球蛋白试验是测定患者血清中有无不完全抗体,抗人球蛋白试验阳性,表示自体免疫溶血性贫血,可进一步作①血清学检查以明确抗体的性质;②查明原发病的性质,例如全身性红斑狼疮、淋巴肉瘤等。
4、酸化血清溶血试验(Ham试验) 即将患者红细胞与加有1/6N盐酸的同型正常血清混合。37℃温箱中孵育1-2小时后,可见溶血现象,即为阳性,阳性结果表示阵发性睡眠性血红蛋白尿。糖水溶血试验也作为诊断阵发性睡眠性血红蛋白尿之过筛试验。
5、高铁血红蛋白还原试验 正常高铁血红蛋白还原率>75%,G-6PD缺乏时还原率降低。此外,荧光点试验、抗坏血酸-氰化物试验及(或)变性珠蛋白小体生成试验阳性结果也表示G6PD缺乏。G6PD缺乏决定性的试验需要酶定量,红细胞溶血产物与G6PD和NADP孵育,以分光光度计340nm测定NADP生成NADPH的还原率。
6、自溶血试验 溶血能被ATP纠正而不被葡萄糖纠正提示丙酮酸激酶缺乏。
7、异丙醇试验及(或)热变性试验 阳性结果表示不稳定血红蛋白。
8、血红蛋白电泳和抗硷血红蛋白试验 用于诊断地中海和其他血红蛋白病。通过血红蛋白电泳分辩某些血红蛋白及其含量,HbA是正常人Hb主要成分,占95%。HbA2含量不超过3%,而抗硷试验则是利用HbF对硷性溶液的抵抗力比其他各种血红蛋白高,在硷性溶液中作用一定时间后,其他各种血红蛋白可变性或沉淀,而HbF则不受影响,以此可检查HbF含量小于2%。
【治疗】
溶血性贫血是一大类性质不同的疾病,其治疗方法不能一概而论。总的治疗原则如下:
一、病因治疗
去除病因和诱因极为重要。如冷型抗体自体免疫性溶血性贫血应注意防寒保暖;蚕豆病患者应避免食用蚕豆和具氧化性质的药物,药物引起的溶血,应立即停药;感染引起的溶血,应予积极抗感染治疗;继发于其他疾病者,要积极治疗原发病。
二、糖皮质激素和其他免疫抑制剂
如自体免疫溶血性贫血、新生儿同种免疫溶血病、阵发性睡眠性血红蛋白尿等,每日强的松40-60mg,分次口服,或氢化考的松每日200-300mg,静滴,如自体免疫溶血性贫血可用环磷酰胺、硫唑嘌呤或达那唑(Danazol)等。
三、脾切除术
脾切除适应证:①遗传性球形红细胞增多症脾切除有良好疗效;②自体免疫溶血性贫血应用糖皮质激素治疗无效时,可考虑脾切除术;③地中海贫血伴脾功能亢进者可作脾切除术;④其他溶血性贫血,如丙酮酸激酶缺乏,不稳定血红蛋白病等,亦可考虑作脾切除术,但效果不肯定。
四、输血
贫血明显时,输血是主要疗法之一。但在某些溶血情况下,也具有一定的危险性,例如给自体免疫性溶血性贫血患者输血可发生溶血反应,给PNH病人输血也可诱发溶血,大量输血还可抑制骨髓自身的造血机能,所以应尽量少输血。有输血必要者,最好只输红细胞或用生理盐水洗涤三次后的红细胞。一般情况下,若能控制溶血,可借自身造血机能纠正贫血。
五、其它
并发叶酸缺乏者,口服叶酸制剂,若长期血红蛋白尿而缺铁表现者应补铁。但对PNH病人补充铁剂时应谨慎,因铁剂可诱使PNH病人发生急性溶血。
